
| A. | 测定其导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:1:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:2:100 |
分析 A.溶液的导电性与离子浓度有关;
B.起始反应速率与氢离子浓度有关;
C.盐酸、硫酸中pH相同,则氢离子的物质的量相同;
D.根据酸具有的氢离子的总物质的量计算.
解答 解:A.溶液的导电性与离子浓度有关,pH相同,则氢离子浓度浓度相同,则溶液的导电性相同,故A正确;
B.起始反应速率与氢离子浓度有关,pH相同,则氢离子浓度浓度相同,与足量的锌粉反应的起始速率相同,故B正确;
C.盐酸、硫酸中pH相同,则氢离子的物质的量相同为c(H+)=10-3mol/L,醋酸(假设醋酸有1%的电离)的浓度为0.1mol/L,所以与足量的锌粉反应产生氢气的体积比为1:1:100,故C正确;
D.盐酸、硫酸中pH相同,则氢离子的物质的量相同为c(H+)=10-3mol/L,氢离子的物质的量相同,消耗的氢氧化钠相同,醋酸(假设醋酸有1%的电离)的浓度为0.1mol/L,则与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:1:100,故D错误;
故选D.
点评 本题考查了弱电解质电离、溶液的导电性、影响反应速率的因素等,注意pH相同醋酸和盐酸两种溶液,醋酸的浓度大,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:填空题
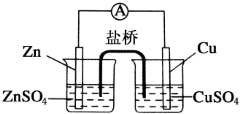 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
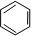 ;一种常见的烃的含氧衍生物:
;一种常见的烃的含氧衍生物: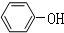 .
.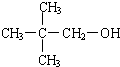 .
.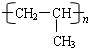 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(OH-) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 还原剂得电子总数与氧化剂失电子总数相等 | |
| C. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| D. | 非金属元素的最高价氧化物的水化物不一定都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-) | |
| B. | 25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液中离子浓度的关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 在0.1 mol/LNH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c (HClO)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  配制一定物质的量浓度的稀硫酸 | B. | 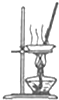 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. | 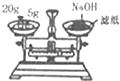 称量NaOH固体 | D. | 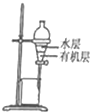 萃取后有机层从下口排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com