
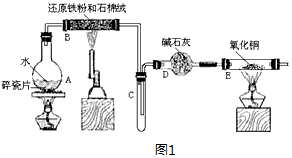

分析 A中圆度烧瓶在加热条件下可提供水蒸气,B在加热条件下,铁与水蒸气反应生成四氧化三铁和氢气,氢气经干燥,在C中用向下排空法可收集到氢气,D为干燥装置,在加热条件下氢气与氧化铜反应生成铜和水,可用KSCN检验铁离子,可用KSCN检验铁离子,以此解答该题.
(1)铁与水蒸气高温下反应生成四氧化三铁和氢气,据此写出反应的化学方程式;
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)B在加热条件下,铁与水蒸气反应生成四氧化三铁和氢气,停止反应,待B管冷却后,取其中的固体,固体的成分可能为四氧化三铁、铁.在固体中加入过量稀盐酸就是四氧化三铁、铁和盐酸之间的反应;
(4)滤液中有FeCl3、FeCl2,通入氯气将FeCl2氧化成FeCl3,再将FeCl3稀溶液进行加热浓缩、冷却结晶、过滤即得FeCl3•6H2O晶体.
①根据流程结合氯气的强氧化性分析氯气的作用;
②根据三价铁的检验方法加KSCN溶液,观察是否变红;
③由FeCl3稀溶液中得到FeCl3•6H2O晶体需加热浓缩、冷却晶体,过滤.
解答 解:(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)在固体中加入过量稀盐酸就是四氧化三铁、铁和盐酸之间的反应,其方程式:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2,故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
②检验三价铁用KSCN溶液,观察是否变红,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
③由FeCl3稀溶液中得到FeCl3•6H2O晶体需加热浓缩、冷却结晶、过滤,故答案为:加热浓缩、冷却结晶、过滤.
点评 本题考查了铁及其化合物的性质实验,题目难度不大,注意掌握铁与水蒸气反应原理,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 32g氧气和臭氧混合物中氧原子的物质的量为2 mol | |
| B. | 2mol的硫酸的摩尔质量为196g/mol | |
| C. | 一定温度和压强下,各种气态物质的体积由构成气体分子的大小决定 | |
| D. | 将58.5gNaCl溶于941.5g水中配成1mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
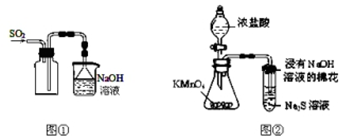
| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 | |
| C. | 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液 | |
| D. | 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生产过程中没有涉及到氧化还原反应 | |
| B. | 生产过程中没有涉及到置换反应 | |
| C. | 该厂生产的主要原料为煤、纯碱 | |
| D. | 该厂生产的最终产品是小苏打及烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
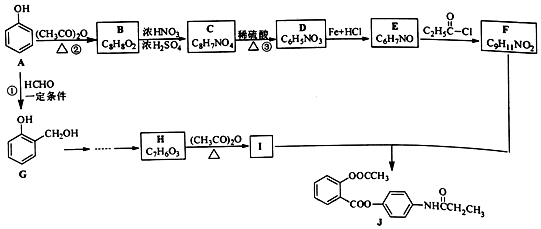
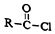 +R′-NH2→
+R′-NH2→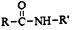 +HCl
+HCl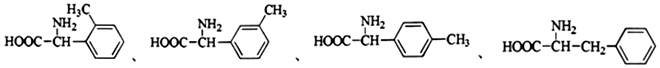 .
.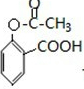 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;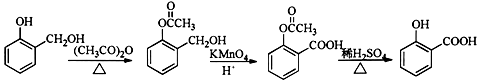 .
.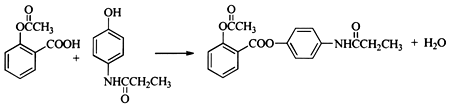 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L lmol•L-1 FeBr2溶液与l molCl2反应时转移的电子数目为3NA | |
| B. | 7g分子式为CnH2n的链烃中含有的C-H键的数目为NA | |
| C. | 常温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 0.5mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4 g,所含硫原子数一定为0.2NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| C. | 在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2,转移的电子数为6NA | |
| D. | 将含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,产生气体的分子数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com