
将烧碱吸收H2S后的溶液加入如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
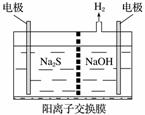
S2--2e-===S (n-1)S+S2-===S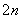
①写出电解时阴极的电极反应式:____________________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________。
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。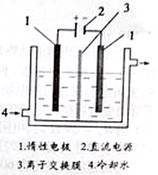 碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。图中的序号3应为 离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 。
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:
KI溶液、 、 ;反应的离子方程式为 。
(5)已知KI+I2 KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样( )
(3)干燥环境下金属不被腐蚀( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀( )
查看答案和解析>>
科目:高中化学 来源: 题型:
以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
有关金属的腐蚀与防护的叙述正确的是( )
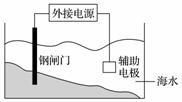
A.金属的化学腐蚀比电化学腐蚀普遍
B.上图装置的原理是“牺牲阳极的阴极保护法”
C.金属腐蚀的本质是M-ne-===Mn+而被损耗
D.用铝质铆钉来接铁板,铁板易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min后测得B口的气体体积为C口处的一半,下列说法不正确的是( )
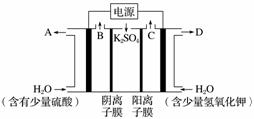
A.电源左侧为正极
B.电解槽左侧的电极反应方程式为2H2O-4e-===O2+4H+
C.D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D.在标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO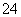 通过阴离子膜
通过阴离子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是
A.X可能是第二周期非金属元素 B. X可能是第三周期金属元素
C.Y可能与X同主族 D.Y一定是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com