
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
136 58 |
138 58 |
140 58 |
142 58 |


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
 .如图所示是九种化合物的转变关系.
.如图所示是九种化合物的转变关系.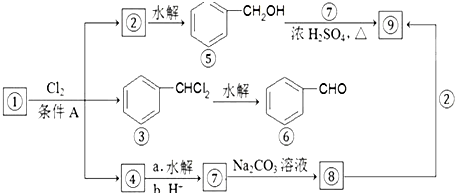
查看答案和解析>>
科目:高中化学 来源: 题型:
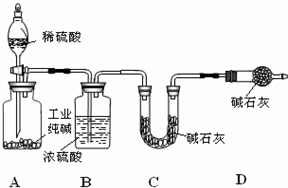 工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:
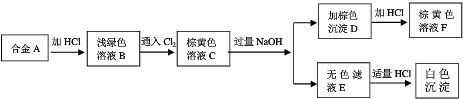
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Fe3+、NH4+、SCN-、HCO3-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
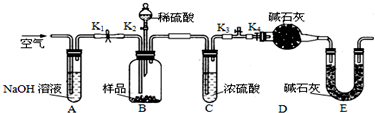
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na2CO3和0.01molNaHCO3,甲、乙中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
Na2CO3和0.01molNaHCO3,甲、乙中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )| A、最终两试管中Na+、Cl-的物质的量一定相同 |
| B、甲装置的气球膨胀速率大 |
| C、若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L |
| D、若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com