
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
①增加Fe的量,其反应速率____(填“增大”、“不变”或“减小”,下同)。
②将容器的体积缩小一半,其反应速率____。
③保持体积不变,充入He,其反应速率____。
④保持压强不变,充入He,其反应速率_____。
(2)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是____(填字母序号)
a.反应速率5v(NH3)=4v(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为_____(选填字母)。

(3)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。写出合成氨反应的热化学方程式____。
(4)一定条件下,在2L密闭容器内,反应2NO2(g)=N2O4(g)△H=-180kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均速度____。在第5s时,NO2的转化率为____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是____。
【答案】不变 增大 不变 减小 bc cd N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol 0.0075mol·L-1·s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小
【解析】
(1)①Fe为固体,浓度视为常数,即增加Fe的量,化学反应速率不变;
②容器的体积缩小一半,即组分浓度增大,化学反应速率增大;
③He属于非反应气体,恒容状态下,充入He,组分的浓度保持不变,化学反应速率保持不变;
④恒压下,充入He,容器的体积增大,组分的浓度降低,化学反应速率减小;
(2)①a、没有指明反应进行的方向,即无法判断是否达到平衡,故a不符合题意;
b、生成N2反应向正反应方向进行,生成NH3反应向逆反应方向进行,且生成量之比等于系数之比,即能说明反应达到平衡,故b符合题意;
c、根据化学平衡状态的定义,N2的物质的量分数不再随时间发生变化,能说明反应达到平衡,故c符合题意;
d、题中没有说明通入NO和NH3的量,无法判断是否达到平衡,故d不符合题意;
答案选bc;
②v(正)与v(逆)相等的点,说明反应达到平衡,根据图象,达到平衡的点是cd;
(3)生成标准状况下2.24L的NH3,即生成0.1mol的NH3,得出生成2molNH3,放出的热量为92.4kJ,合成氨的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol;
(4)根据化学反应速率的数学表达式,v(NO2)=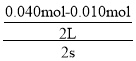 =0.0075mol/(L·s);5s内消耗NO2的物质的量为(0.040mol-0.005mol)=0.035mol,即NO2的转化率为
=0.0075mol/(L·s);5s内消耗NO2的物质的量为(0.040mol-0.005mol)=0.035mol,即NO2的转化率为![]() ×100%=87.5%;随着反应的进行,NO2的物质的量浓度减小,物质的量浓度起主导作用,即化学反应速率减小。
×100%=87.5%;随着反应的进行,NO2的物质的量浓度减小,物质的量浓度起主导作用,即化学反应速率减小。


科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效水处理剂,广泛应用于工业废水、城市污水、工业用水及生活饮用水等的净化处理。其一种合成方法流程如下:
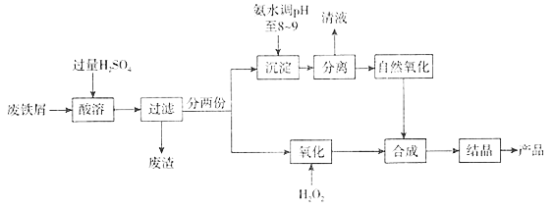
回答下列问题
(1)聚合硫酸铁分子式可表示为[Fe2(OH)n(SO4)x]m,其中Fe化合价为+3,则x=___________(用含n的代数式表示)。
(2)分离阶段通常使混合物经静置后倾去上层清液即可。清液中所含的主要离子是___________。
(3)在自然氧化阶段,经分离得到的絮状沉淀会被空气氧化。该阶段完成的标志是沉淀颜色变为___________。发生反应的化学方程式为______________________,为了使反应充分,还可以采取的措施有______________________(写一条即可)。
(4)在氧化阶段,发生的主要反应的离子方程式为_________________________________。反应要求必须在搅拌下缓缓加入双氧水,除了因为该反应放热,反应剧烈,为防止危险外,还因为_________________________________。
(5)为了检验所得产品中是否含有Fe2+ (不含其他还原性物质),取少量样品完全溶于水,并加水稀释,此时溶液几乎无色。然后用0.01mol/L的酸性高锰酸钾标准溶液滴定。则滴定至终点时的实验现象是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2SO4的相对分子质量为142,则500mL1.0mol·L-1Na2SO4溶液含有溶质质量为( )
A.35.5gB.71gC.119gD.142g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B. ![]() 的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C. ![]() 的溶液:NH4+、Cu2+、NO3-、Cl-
的溶液:NH4+、Cu2+、NO3-、Cl-
D. 水电离的c(H+)=1×10﹣13 mol·L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式错误的是( )
A. CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B. 等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C. NaHCO3溶液中存在水解平衡:HCO3-+H2OH2CO3+OH-
D. 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) ![]() +
+![]() + c(OH-)
+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法,与其化学性质无关的是( )
A.金属钠保存在煤油中
B.浓盐酸需密闭保存
C.新制氯水密闭存放于棕色瓶中
D.过氧化钠需保持干燥密闭保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述不正确的是

A. 反应的化学方程式为:3N ![]() 2M
2M
B. t2时,正、逆反应速率不相等
C. t3时,正反应速率等于逆反应速率,达到平衡
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com