
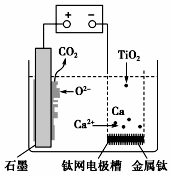
 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
分析 根据图知,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2 $\frac{\underline{\;一定条件下\;}}{\;}$Ti+2CaO,“+”接线柱应连接原电池正极,“-”接线柱应连接原电池负极,据此分析解答.
解答 解:A.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变,故A正确;
B.阳极上电极反应式为C+2O2--4e-═CO2↑,故B正确;
C.由TiO2制得1mol金属Ti,Ti元素化合价由+4价降低到0价,则理论上外电路转移4mol电子,故C错误;
D.“-”表示原电池负极,所以“-”接线柱应连接原电池负极,即Pb极,故D正确;
故选C.
点评 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 有大量NO3-存在的强酸性溶液中:NH4+、Na+、Fe3+、SO42- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变蓝的溶液中:ClO-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
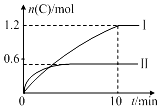 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )| 实验序号 | 温度 | 起始物质的量 | 热量变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5 mol | -- |
| A. | a=160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34gH2O2中含有的阴离子数为1NA | |
| B. | 4.6g乙醇中含有的C-H键的个数为0.6NA | |
| C. | 标准状况下,VL水含有的氧原子个数约为$\frac{V}{22.4}$ | |
| D. | 1molFe2+与足量的H2O2溶液反应,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(HCl)<n(NH3•H2O) | B. | 盐酸过量 | C. | 恰好中和 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com