

| A. | 西维因分子式为C12H10NO2 | |
| B. | 西维因分子中至少有21个原子共平面 | |
| C. | 1mol西维因最多能与6mol氢气发生加成反应 | |
| D. | 反应后的溶液经酸化,可用FeCl3溶液检验西维因是否已经发生水解 |
分析 根据有机物的结构简式判断含有的元素的种类和原子个数,可确定有机物的分子式,含有机物中含有萘基,含有羧基和肽键,结合有机物的基团或官能团的性质判断.
解答 解:A.由结构简式可知该有机物中含有12个C、11个H、1个N以及2个O原子,则分子式为C12H11NO2,故A错误;
B.萘基上的所有原子共平面,酯基上的原子可共平面,则最多可有21个原子共平面,故B错误;
C.只有萘环与氢气发生加成反应,则1mol西维因最多能与5mol氢气发生加成反应,故C错误;
D.西维因水解生成酚羟基,则可用FeCl3溶液检验西维因是否已经发生水解,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题易错点为B,注意原子共平面问题的分析.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
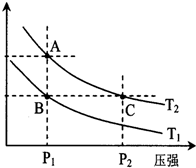 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处于平衡状态,正逆反应速率相等 | |
| B. | 平衡逆移,正反应速率小于逆反应速率 | |
| C. | CO2的转化率为50% | |
| D. | 该条件下,学平衡常数K=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质均含有约6.02×1023个分子 | |
| B. | 0.012kg碳-12中含有约6.02×1023个碳原子 | |
| C. | 1mol水中含有2 mol氢和1mol氧 | |
| D. | 1mol H2含有6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 101 | B. | 17 | C. | 32 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
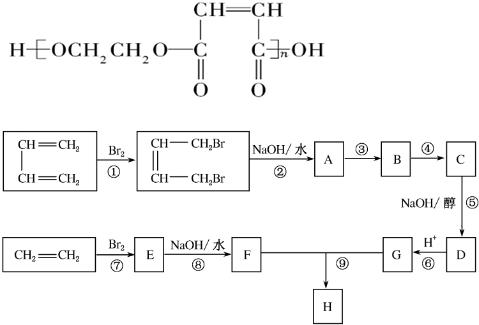
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com