
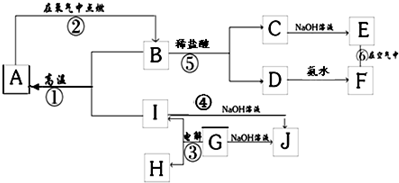
①A+B![]() M+D+E;②M+E
M+D+E;②M+E![]() A+F+B。请针对以下两种不同情况回答:
A+F+B。请针对以下两种不同情况回答:
(1)若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为__________;反应②的离子方程式为____________________________________;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,反应的离子方程式为_____________________________________________________________。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,X单质的熔点是
(1)![]() Cl2+2OH-
Cl2+2OH-![]() Cl-+ClO-+H2O 2Fe2++ClO-+2H+
Cl-+ClO-+H2O 2Fe2++ClO-+2H+![]() 2Fe3++Cl-+H2O
2Fe3++Cl-+H2O
(2)分子 2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
解析:常见的两种物质生成三种物质的化学反应有氯气与氢氧化钠或氢氧化钙溶液反应、电解饱和食盐水等。本题(1)中提示了A为钠盐,故可知A为氯化钠,再根据反应②可知M为氢氧化钠、E为氯气。根据(2)中“X的原子最外层电子数是电子层数的2倍”可推测X为碳或硫,又因“X单质的熔点是


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 3 |
| 2 |
 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2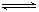 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3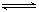 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式
|
|
| ||
| ||
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
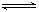 HSO3-+OH-
HSO3-+OH-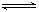 HSO3-+OH-
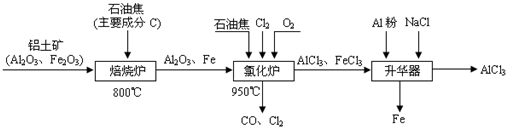
HSO3-+OH-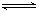 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是查看答案和解析>>
科目:高中化学 来源: 题型:
①A+B![]() M+D+E ②M+E
M+D+E ②M+E![]() A+F+B
A+F+B
请针对以下两种不同情况回答:
(1)A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。A的化学式为______________,反应②的离子方程式为______________。
(2)当A是一种铜盐时,A中的酸根离子可以是下列的_______(填序号);
①Cl- ②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
若该铜盐中的一个酸根离子共含有50个电子,则反应②的化学方程式为________________
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.已知:反应 H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol
![]()

请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ![]() ,
,
它所对应的化学方程式为: .
(2)已知在400℃时,N2 (g)+ 3H2(g) ![]() 2NH3(g) △H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
2NH3(g) △H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g) ![]() 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com