
分析 (1)氯水中含有具有漂白作用的次氯酸;加入碳酸钠生成白色沉淀说明沉淀是碳酸钙;氯气与水反应Cl2+H2O=HCl+HClO,加入碳酸钙,观察到氯水的黄绿色褪去,同时产生少量气体,因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,滴加盐酸可产生大量气体,该气体是二氧化碳;加入碳酸钙,观察到氯水的黄绿色褪去,同时产生少量气体,因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,该清液加热后变浑浊并产生大量气体是碳酸氢钙分解生成碳酸钙沉淀和二氧化碳气体;
(2)依据反应产物中有HClO、Ca(HCO3)2、CaCl2,书写化学方程式.
解答 解:(1)清液滴在有色布条上有极强的漂白作用.说明该清液中含有具有漂白性的次氯酸;清液中滴加碳酸钠溶液产生白色沉淀.说明该清液中含有钙离子,生成沉淀碳酸钙;加热后产生浑浊的原因是因为溶液中的碳酸氢钙分解生成碳酸钙水和二氧化碳气体,生成了沉淀碳酸钙,反应方程式为Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO2↑H2O,
故答案为:HClO;Ca2+;CO2;CaCO3;
(2)根据实验二(1)-(4)实验步骤发生的反应和物质判断可知氯水和碳酸钙反应的化学方程式为2CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO,
故答案为:2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO.
点评 本题主要考查氯及其化合物的相关的实验,题目难度不大,答题时注意根据发生的反应正确描述反应现象.


科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环己烷) | 水 | 分液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |

 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
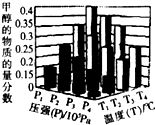 反应3H2(g)+CO2(g)?CH3OH(g)+H20(g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,
反应3H2(g)+CO2(g)?CH3OH(g)+H20(g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,| A. | P3>P2,T3>T2 | B. | P2>P4,T4>T2 | C. | P1>P3,T1>T3 | D. | P1>P4 T2<T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和溴用铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硝酸酸化的AgNO3溶液检验Cl- | |
| D. | 向淀粉在酸性条件下水解的产物中加银氨溶液,水浴加热,检验葡萄糖的生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com