
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶. | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴 | |
| D. | 用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 测试时间(H) | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH: | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法,化合物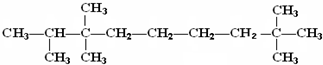 的名称为:2,3,3,8,8-五甲基壬烷 的名称为:2,3,3,8,8-五甲基壬烷 | |
| B. | 将少量溴水加入石油裂化得到的汽油中,溴水分层,上层为橙红色 | |
| C. | 往2ml10%的CuSO4溶液中加入5滴5%的NaOH溶液,再加入2ml10%的葡萄糖溶液,加热,得到砖红色的氧化亚铜沉淀 | |
| D. | 甲烷、乙醇、乙酸在一定条件下都能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com