
下列叙述正确的是()
A. 含有最低价元素的化合物不一定具有很强的还原性
B. 元素的单质一定是由氧化或还原该元素的化合物制得
C. 阳离子只能得电子被还原,阴离子只能失电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: A.含有最低价的元素的化合物不一定具有很强的还原性,如HF;
B.元素的单质不一定是由氧化或还原该元素的化合物制得;
C.阳离子可能失电子被氧化,阴离子可能被得电子被还原;
D.在化学反应中,得电子越容易的氧化剂其氧化性越强.
解答: 解:A.含有最低价的元素的化合物不一定具有很强的还原性,如HF没有强还原性,故A正确;
B.元素的单质不一定是由氧化或还原该元素的化合物制得,如由空气分离得到氧气,故B错误;
C.阳离子可能失电子被氧化,如亚铁离子,阴离子可能被得电子被还原,如高锰酸根离子、高铁酸根离子等,故C错误;
D.在化学反应中,得电子越容易的氧化剂其氧化性越强,失电子越容易的还原剂其还原性越强,故D错误;
故选A.
点评: 本题考查氧化还原反应,易错选项是C,注意氧化性强弱与得电子多少无关,只与得电子难易程度有关,为易错点.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
下列叙述正确的是()
A. Fe、Cu、Al在空气中都容易生锈是因为都生成了对应的氧化物
B. FeCl3、FeCl2和Fe(OH)3都可以通过化合反应得到
C. 高温时,CuO比Cu2O稳定,Na2O2比Na2O稳定
D. Si02不溶于水,不是酸性氧化物,但能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或实验所得出的结论正确的是()
A. 
实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签
B. 制备Fe(OH)3胶体时,应向沸水中逐滴加入1mol•L﹣1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C. 用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘
D. 用50mL量筒量取5.6mL浓硫酸
E. 用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出
F. 用广泛pH试纸测得某溶液的pH为4.8
查看答案和解析>>
科目:高中化学 来源: 题型:
NO2通过盛有水的洗气瓶,转移0.02mol电子时,参加反应的NO2气体在标准状况下的体积为()
A. 224mL B. 336mL C. 448mL D. 672mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①用丁达尔效应可以区分食盐水和淀粉溶液
②一种盐和另外一种盐反应一定生成两种新盐
③与Al反应且只产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3﹣
④由CaCO3的溶解度小于Ca(HCO3)2,可推出Na2CO3的溶解度小于NaHCO3
⑤向溶液中滴入盐酸,无现象,再加氯化钡溶液,可检验溶液中是否含有SO42﹣
⑥标准状况下,0.5NA个NO分子与0.5NA个O2分子混合后的体积约为22.4L.
A. ①③ B. ①④ C. ①⑤ D. ①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是()
A. Na+、H+、Cl﹣、NO3﹣ B. Na+、Mg2+、Cl﹣、SO42﹣
C. K+、Ba2+、OH﹣、I﹣ D. Cu2+、CO32﹣、Br﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置探究铁在海水中的电化学腐蚀与防护.下列说法不正确的是()
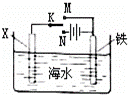
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH﹣﹣4e﹣=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e﹣+2H2O=4OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com