常温下,浓度均为0.1mol/L的四种溶液:①Na
2CO
3溶液 ②NaHCO
3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是
①②
①②
(填编号,下同),溶液中溶质存在电离平衡的是
②④
②④
;
(2)比较①、②溶液,pH值较大的是
①
①
;
(3)在溶液④中加入少量NH
4Cl固体,此时C(NH
4+)/C(OH
-)的值将
变大
变大
(填“变小”、“变大”或“不变”);
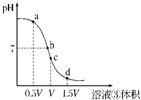
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是
c
c
点,理由是
恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
;
②a点溶液中离子浓度大小关系是
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H
+、OH
-外,离子浓度大小关系是
C(Cl-)=c(NH4+)+C(Na+)
C(Cl-)=c(NH4+)+C(Na+)
.

 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水

 名校课堂系列答案
名校课堂系列答案 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题: (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.