
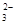 +O2+xOH—
+O2+xOH— +2H2O,
+2H2O,| A.每生成1mol Fe3O4,反应转移的电子总数为3mol ; |
| B.x="6" |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol; |
| D.Fe2+和S2O32—-都是还原剂; |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 |
| B.若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) |
| C.若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol |
| D.KNO3的氧化性强于N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
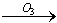 BrO-
BrO-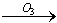 BrO2-
BrO2-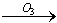 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 (不要求写具体操作过程,仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,………… | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用食醋除去热水瓶胆壁上的水垢 | B.用次氯酸钠溶液消毒浴池 |
| C.盐卤用于制豆腐 | D.用小苏打发酵面团制作馒头 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com