
【题目】现有![]() 碳酸钠溶液,对溶液中离子浓度关系的描述,不正确的是
碳酸钠溶液,对溶液中离子浓度关系的描述,不正确的是![]()
![]()
A. ![]()
![]()
B. ![]()
C. ![]()
![]()
D. ![]()
![]()
【答案】D
【解析】A.0.1mol/L的碳酸钠溶液中,溶液中存在的离子有Na+、H+、OH-、CO32-、HCO3-,由于溶液要满足电荷守恒,故有c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故A正确;B.在碳酸钠溶液中,氢离子和氢氧根全部来自水的电离,而水电离出的氢离子和氢氧根的总量相同,而水电离出的氢离子被CO32-部分结合为HCO3-和H2CO3,根据质子守恒可知:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),故B正确;C.在碳酸钠中,钠离子和碳酸根的个数之比为2:1,而在溶液中,碳酸根部分水解为H2CO3、HCO3-,根据物料守恒可知:c(Na+)=2[c(H2CO3)+c(CO32-)+c(HCO3-)],故C正确;D.0.1mol/L的碳酸钠溶液中,溶液中存在的离子有Na+、H+、OH-、CO32-、HCO3-,由于溶液要满足电荷守恒,故有c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故D错误;本题选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是由有机物X加聚制得的热塑性塑料,为透明如玻璃状的无色固体,可用以制造航空窗玻璃、仪表盘、外科照明灯、装饰品和生活用品等.其结构简式为: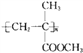 请回答下列问题:
请回答下列问题:
(1)写出X的结构简式_____________________;
(2)有机物X不能发生的反应有________(填写序号);
①和氢气加成 ②使溴水褪色 ③被酸性高锰酸钾溶液氧化 ④水解反应 ⑤酯化反应
(3)有机物X有多种同分异构体,其中含有2个甲基且属于羧酸类的有机分子的结构简式为________________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
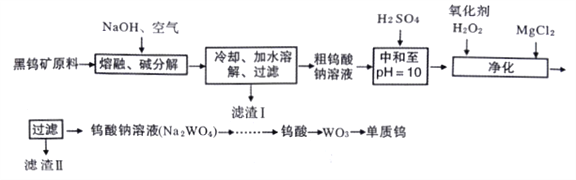
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
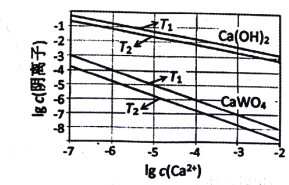
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+ 、Br-、SO42 -
B. ![]() =106的溶液中:NH4+ 、K+、AlO2- 、NO3-
=106的溶液中:NH4+ 、K+、AlO2- 、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42 -、Cl-
D. 0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+ 、CO32 -、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
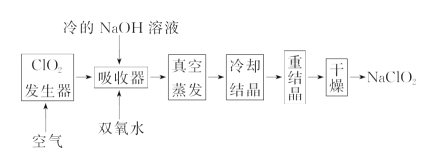
(1)ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为_______________。
②用CO、O2和固体电解质还可以制成如下图所示的燃料电池,则电极d的电极反应式为__________。
(5)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图所示。
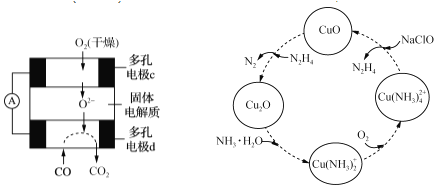
①在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
②加入NaClO时发生的反应为:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B气体置于1 L的密闭容器中,混合后发生如下反应:2A(s) + B(g)=2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确的是( )
A. 用物质A表示的反应速率为0.6mol/(L·s)
B. 用物质B表示的反应速率为1.2mol/(L·s)
C. 2 s时物质A的转化率为30%
D. 2 s时物质B的浓度为0.6 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com