
| A. | H2SO4(浓)+C | B. | Fe3O4+Al | C. | Cl2+Mg | D. | NO2+H2O |
分析 由发生的反应结合元素的化合价判断氧化剂、还原剂,利用反应确定氧化剂与还原剂物质的量之比为2:1,以此来解答.
解答 解:A.发生2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑,S元素的化合价降低,C元素的化合价升高,则H2SO4为氧化剂,C为还原剂,物质的量比为2:1,故A不选;
B.发生3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,Al元素的化合价升高,Fe元素的化合价降低,则Fe3O4为氧化剂,Al为还原剂,物质的量比为3:8,故B不选;
C.发生Cl2+Mg$\frac{\underline{\;点燃\;}}{\;}$MgCl2,氯气为氧化剂,Mg为还原剂物质的量比为1:1,故C不选;
D.发生3NO2+H2O=2HNO3+NO,二氧化氮既是氧化剂也是还原剂,N元素化合价降低的为氧化剂,氧化剂与还原剂物质的量之比为1:2,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,题目难度不大.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: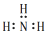 | B. | Mg2+结构示意图  | ||
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U互为同位素 | D. | 乙醇的分子式C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比c(X):c(Y):c(Z)=2:3:4 | B. | 消耗2molX,同时消耗4molZ | ||
| C. | 混合气体的密度保持不变 | D. | 反应放出akJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,8.0gSO3体积为2.24L | |
| B. | 物质的量为1molSO2、CO2的混合物所含氧原子数为2NA | |
| C. | 0.1molFeCl3溶液中含有的Fe3+数为0.1NA | |
| D. | 0.5mol镁在空气中完全燃烧所需要的氧气的物质的量为0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
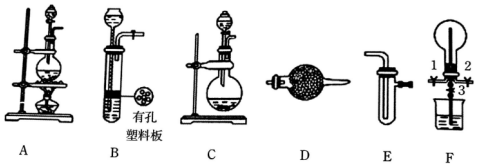
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| C | 鉴别 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| D | 提纯 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com