
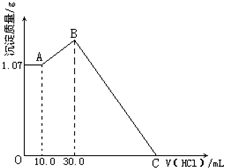
 将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:
将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:| 1.07g |
| 107g/mol |
| 0.12mol |
| 1mol/L |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、2.24L HCl气体中含有0.1NA个HCl分子 |
| B、室温下,1molCH4含有的电子数为10NA |
| C、将0.1mol FeCl3溶于1L水中,所得溶液中含有0.1NA个Fe3+ |
| D、25℃时,1LpH=13的Ba(OH)2溶液中含有0.2NA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一周期中,碱金属元素的第一电离能最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、若X原子2p轨道上有一个空轨道,Y原子3p轨道上只有一个空轨道,则它们一定同主族 |
| D、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子则它们一定同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、91.6% |
| B、83.2% |
| C、75.0% |
| D、67.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中,只可能大量含有下表所列离子中的某几种:
某混合溶液中,只可能大量含有下表所列离子中的某几种:| 阳离子 | H+、K+、Al3+、NH
| ||
| 阴离子 | OH-、SO42-、CO32-、AlO2-、S2- |
| 离子种类 | ||||||
| 物质的量(mol) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com