
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: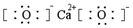 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.铝离子的核外电子总数为10,最外层含有8个电子;
C.过氧化钙构成离子是钠离子和过氧根离子,过氧根离子的电子式错误;
D.C3H7Br为分子式,结构简式中需要表示出有机物结构特点.
解答 解:A.质子数与中子数相等的硫原子的质量数为32,该原子可以表示为:${\;}_{16}^{32}$S,故A正确;
B.铝是13号元素,最外层有3个电子,Al3+是将原子的外层3个电子失去,次外层做最外层,铝离子正确的离子结构示意图为: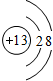 ,故B错误;
,故B错误;
C.过氧化钙构成离子是钠离子和过氧根离子,过氧化钙为离子化合物,钙离子直接写成离子形式,过氧根离子需要标出最外层电子,过氧化钙的电子式为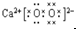 ,故C错误;
,故C错误;
D.2-溴丙烷分子中,官能团Br原子在2号C,正确的结构简式为:CH3CH2BrCH3,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度不大,涉及电子式、元素符号、结构简式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
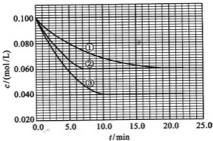 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
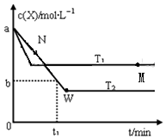 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
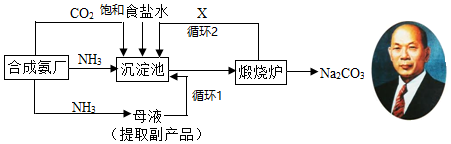
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦⑧ | B. | ①③⑤⑦⑧ | C. | ①③⑤⑧ | D. | ②④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
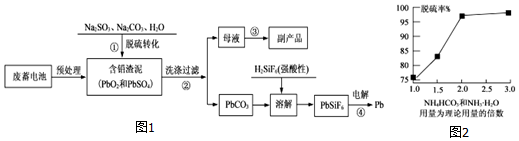
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com