
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
分析 A.氢离子与碳酸根离子反应;
B.钙离子与硫酸根离子反应生成硫酸钙沉淀;
C.银离子、镁离子与硫离子发生反应;
D.四种离子之间不发生反应,能够配制成功.
解答 解:A.H+、CO32-之间发生反应,不能大量共存,则无法配制该溶液,故A错误;
B.Ca2+、SO42-之间反应生成硫酸钙沉淀,不能大量共存,所以无法配制该溶液,故B错误;
C.Ag+、Mg2+与S2-之间发生反应,在溶液中不能大量共存,则无法配制该溶液,故C错误;
D.Na+、Cu2+、Cl-、SO42-之间不发生反应,可以大量共存,故能够配制该溶液,故D正确;
故选D.
点评 本题以配制溶液为载体考查了离子共存,为高考热点内容,熟悉离子共存的条件及物质的性质是解本题关键,注意隐含条件的挖掘,试题培养了学生灵活应用基础知识的能力.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:填空题
 CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应.
CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应. .
. +4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+
+4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤⑦ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性>W的氢化物稳定性 | |
| C. | 化合物X2W2和Y2W3中都不含配位键 | |
| D. | 1 mol ZW2晶体所含Z-W键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
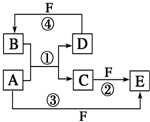 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
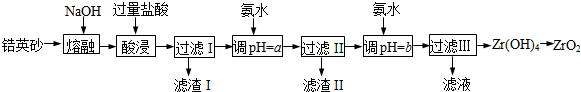
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com