
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I-可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50mL该溶液与过量Zn充分反应,生成0.56gFe |
分析 A.亚铁离子能和[Fe(CN)6]3-反应生成蓝色沉淀;
B.酸性条件下亚铁离子能被硝酸根离子氧化;
C.通入H2S气体时,硝酸亚铁和硫化氢发生氧化还原反应,且FeS能和硝酸反应;
D.Zn和亚铁离子发生置换反应生成Fe.
解答 解:A.亚铁离子能和[Fe(CN)6]3-反应生成蓝色沉淀,该反应还用于检验亚铁离子,所以不能共存,故A错误;
B.酸性条件下亚铁离子能被硝酸根离子氧化生成铁离子,硝酸根离子被还原生成NO,溶液由浅绿色转化为黄色,故B错误;
C.通入H2S气体时,硝酸亚铁和H2S反应可以生成Fe 3+、S,故C错误;
D.Zn和亚铁离子发生置换反应生成Fe,根据原子守恒得析出n(Fe)=n[Fe(NO3)2]=0.2mol/L×0.05L=0.01mol,m(Fe)=0.01mol×56g/mol=0.56g,故D正确;
故选D.
点评 本题以硝酸亚铁为载体考查氧化还原反应,涉及氧化还原反应计算、离子共存等知识点,明确物质性质是解本题关键,注意原子守恒的灵活运用,易错选项是C.


科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
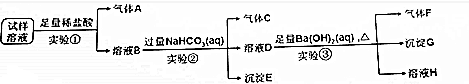
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
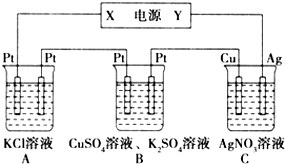 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com