
【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
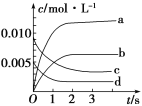
(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
【答案】是 65% b 0.001 5 mol·L-1·s-1 bcd
【解析】
(1)该反应是可逆反应,5s时反应达到平衡,依据转化率公式计算;
(2)由方程式2NO(g)+O2(g) ![]() 2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时保持不变;由速率公式和反应速率之比等于化学计量数之比计算;
2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时保持不变;由速率公式和反应速率之比等于化学计量数之比计算;
(3)由影响反应速率的因素分析。
(1)该反应是可逆反应,5s时,NO转化率为(0.020-0.007)mol/0.020mol×100%=65%,故答案为:是;65%;
(2)由方程式2NO(g)+O2(g) ![]() 2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=(0.020-0.007)mol/2L=0.0065mol/L,故表示NO2变化曲线的为b;0~2s内v(NO)=[(0.020-0.008)mol/2L]/2s=0.003 mol·L-1·s-1,由反应速率之比等于化学计量数之比可得v(O2)= 0.001 5 mol·L-1·s-1,故答案为:b;0.001 5 mol·L-1·s-1;
2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=(0.020-0.007)mol/2L=0.0065mol/L,故表示NO2变化曲线的为b;0~2s内v(NO)=[(0.020-0.008)mol/2L]/2s=0.003 mol·L-1·s-1,由反应速率之比等于化学计量数之比可得v(O2)= 0.001 5 mol·L-1·s-1,故答案为:b;0.001 5 mol·L-1·s-1;
(3)及时分离出NO2气体,反应速率减慢,a错误;
适当升高温度,反应速率加快,b正确;
增大O2的浓度,反应物浓度增大,反应速率加快,c正确;
选择高效的催化剂,反应速率加快,d正确;
故选bcd,故答案为:bcd。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍、铂、镧等过渡金属单质及化合物在医疗等领域有广泛的应用。
(1)基态镍原子的价电子排布式为__________。
(2)抗癌药奥钞利铂(又名乙二酸铂)的结构简武如图所示。
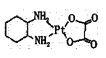
①分子中氮原子杂化轨道类型是______,C、N、O三种元素的第一电离能由大到小的顺序为________。
②1mol乙二酸分子中含有σ键的数目为_____NA。
(3)碳酸澜[La2(CO3)3]可用于治疔高磷血症。
①写出与CO32-互为等电子体的一种分子的化学式________。
②镧镍合金可用于储氢,储氢后晶体的化学式为LaNi5(H2)3,最小重复结构单元如图所示(![]() 、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。
、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。

(4)用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。
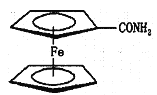
①巳知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁平酰胺晶体为______晶体。
②二茂铁甲酰胺中存在的化学键_________。
③碳氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下NH3的沸点比CH4的沸点高,主要原因是______________。
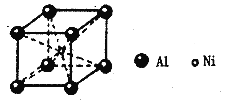
(5)铝镍合金的晶胞如图所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数,则晶胞中镍、铝原子的最短核间距(d)为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
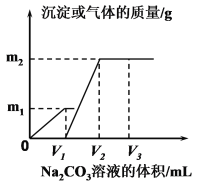
已知:图中 V1 :V2=1:2,当加入 V2mL Na2CO3溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______(2)m2=______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. 90 oC,纯水的pH<7
B. 黄绿色的氯水光照后颜色变浅
C. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
D. 重铬酸钾溶液中滴加氢氧化钠溶液,溶液由橙色变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为雾霾的主要成分示意图。下列说法正确的是( )
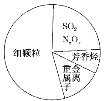
A. 雾能产生丁达尔效应,凡是直径在在1-100nm 之间的粒子都属于胶体
B. SO2能使酸性KMnO4溶液褪色,表现漂白性
C. 苯,二甲苯,硝基苯都是芳香烃
D. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在强碱性溶液中可以大量共存的离子组是( )
A.K+、 Cu2+、SO32-、MnO4-B.NH4+、Fe2+、NO3-、H+
C.HCO3-、Na+ 、Mg2+、Cl-D.Na+、K+、SO42-、 NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于石油组成的下列叙述中,正确的是( )
A. 石油只含碳、氢两种元素,是多种烃的混合物
B. 石油化学工业是生产石油产品或化学用品的工业,它的原料是石油
C. 石油是液态的物质,只含液态烃
D. 石油的大部分是液态烃,其中溶有气态烃和固态烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com