
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
【答案】B
【解析】
9.5 g MgCl2可生成AgCl的质量为143.5 g·mol-1×![]() ×2=28.7 g,现生成AgCl的质量为28 g,说明杂质中的含氯量小于MgCl2的含氯量,氯化镁中Cl和Mg的质量比为71∶24。
×2=28.7 g,现生成AgCl的质量为28 g,说明杂质中的含氯量小于MgCl2的含氯量,氯化镁中Cl和Mg的质量比为71∶24。
A.NaCl中Cl和Na的质量比为71∶46,杂质氯含量低于MgCl2,含此杂质有可能,A不合题意;
B.AlCl3中Cl和Al的质量比为35.5×3∶27=71∶18,杂质氯含量高于MgCl2,含此杂质不可能,B符合题意;
C.CaCl2中Cl和Ca的质量比为71∶40,含此杂质有可能,C不合题意;
D.FeCl3中Cl和Fe的质量比为35.5×3∶56≈71∶37.3,杂质氯含量低于MgCl2,有可能,D不合题意。
故选B。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.100g 98%![]() 溶液中含氧原子数为
溶液中含氧原子数为![]()
B.28g![]() 与
与![]() 混合气体中含有原子的数目为
混合气体中含有原子的数目为![]()
C.标准状况下,11.2L![]() 含有的分子数为
含有的分子数为![]()
D.含有![]() 个氧原子的氧气在标准状况下的体积为22.4L
个氧原子的氧气在标准状况下的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,![]() 与
与![]() (均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,
,![]() 的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
(3)某化学社团的同学对仅由两种元素组成的化合物X进行研究,实验过程形成如图示:
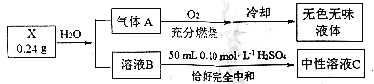
已知:A为单质,B的焰色反应只显示黄色。
写出X与水反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(![]() )的性质与氨气相似,将pOH相同、体积均为
)的性质与氨气相似,将pOH相同、体积均为![]() 的CH3NH2H2O和
的CH3NH2H2O和![]() 两种溶液分别加水稀释至体积为V,pOH随
两种溶液分别加水稀释至体积为V,pOH随![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
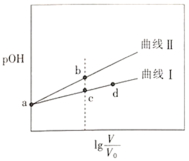
已知:常温下,![]() ,pOH=-lgc(OH-)。
,pOH=-lgc(OH-)。
A.稀释相同倍数时,CH3NH2H2O的浓度比![]() 的浓度大
的浓度大
B.溶液中水的电离程度:b点大于c点
C.由c点到d点,溶液中![]() 保持不变
保持不变
D.常温下,某盐酸的![]() ,a点时CH3NH2H2O的
,a点时CH3NH2H2O的![]() ,当
,当![]() 时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________。
②CTCN的化学式为![]() ,与Co3+形成配位键的原子是________。(已知CO32的结构式为
,与Co3+形成配位键的原子是________。(已知CO32的结构式为![]() )
)
③![]() 可以
可以![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,![]()
![]() 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。
④![]() 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
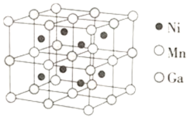
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________。
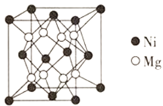
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________(列出计算表达式,NA表示阿伏加德罗常数的数值) gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
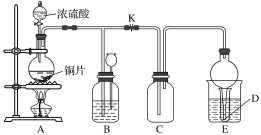
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:_____________________________。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是______________________。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)______________。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是____________________。B中应放置的液体是________(填字母)。
A 饱和Na2SO3溶液 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸还未能使Cu完全溶解。你认为原因是______________________。
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是________(填字母)。
A Fe B BaCl2溶液 C Ag D Na2CO3溶液
(4)实验中该同学向A中反应后溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是__________(填名称),反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升?__________
(2)反应后溶液中各溶质的离子浓度是多少?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下CO2和H2S发生如下反应:CO2(g) +H2S(g)COS(g) +H2O(g)。有关实验数据如下:
实验 | 温度 | 物质的起始物质的量/(mol) | 平衡时COS物质的量/(mol) | |
n(CO2) | n(H2S) | n(COS) | ||
I | 337℃ | 0.10 | 0.40 | 0.01 |
II | 347℃ | 0.10 | 0.40 | 0.015 |
下列说法不正确的是
A.该反应为吸热反应
B.实验I达平衡后COS的物质的量分数为5%
C.实验I温度下,反应的平衡常数为![]()
D.平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,相同温度下再达平衡时n(COS)=0.03mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com