
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.分析 (1)Na与水反应生成NaOH和氢气,Al与NaOH溶液反应也生成氢气;
(2)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,Cu与稀硫酸不反应;
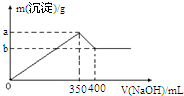
(3)在AlCl3和MgCl2的混合溶液中滴加NaOH溶液,生成的沉淀逐渐增加,当沉淀达到最大量后,氢氧化铝沉淀开始溶解,然后根据图象中数据列式计算即可.
解答 解:(1)钠与水发生的离子反应方程式为:2Na+2H2O═2Na++2OH-+H2↑,n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,生成氢气的体积为0.1mol×22.4L/mol=2.24L,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,则充分反应生成的气体体积大于2.24L,
故答案为:2Na+2H2O═2Na++2OH-+H2↑、2Al+2H2O+2OH-═2AlO2-+3H2↑;大于;
(2)发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(H2SO4)=0.5L×18.4mol/L=9.2mol,由反应可知生成的SO2物质的量为4.6mol,但Cu与稀硫酸不反应,则生成的SO2物质的量小于4.6mol,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;随着反应的进行硫酸浓度逐渐减小,反应停止;
(3)设氯化铝的物质的量浓度为x,氯化镁的浓度为y,
溶解氢氧化铝的反应为Al(OH)3+OH-═AlO2-+2H2O,总共消耗了400mL-350mL=50mLNaOH溶液,n(NaOH)=0.05L×2mol/L=0.1mol,则氢氧化铝的物质的量为0.1mol;生成沉淀最大时发生Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,共消耗NaOH为0.35L×2mol/L=0.7mol,则
Al3++3OH-=Al(OH)3↓
0.1mol 0.3mol 0.1mol
Mg2++2OH-=Mg(OH)2↓
0.2mol 0.4mol 0.2mol
则生成沉淀为0.1mol+0.2mol=0.3mol,
可知a=0.1mol×78g/mol+0.2mol×58g/mol=19.4,b=0.2mol×58g/mol=11.6,
故答案为:19.4;11.6.
点评 本题考查金属及化合物的性质,为高频考点,把握发生的反应及现象、物质的量关系为解答的关键,侧重分析与应用、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
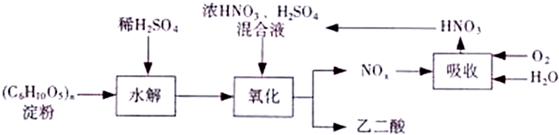
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 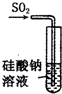 装置:可证明H2SiO3酸性与H2SO3酸性强 | |
| B. |  装置:橡胶管的作用是能使水顺利流下 | |
| C. | 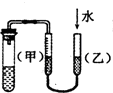 装置:用图示的方法能检查此装置的气密性 | |
| D. | 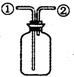 装置:可在瓶中先装入某种液体收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe304与稀硝酸反应的离子方程式为:3Fe3O4+28H++N03一═9Fe3++NO↑+14H20 | |
| B. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++C02↑+3H2O | |
| C. | 向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀:2Ba2-+NH4++Al3++2SO42-+40H-═Al(OH)3↓+NH3•H20+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++OH-+HC03-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸、亚硫酸和次氯酸都是见光易分解的挥发性酸 | |
| B. | 合金属于金属单质,很多性能与组成它的纯金属不同 | |
| C. | 金属及其氧化物、氢氧化物都不可能与强碱溶液反应 | |
| D. | 元素的非金属性、金属性强弱与其得失电子数目无直接关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | NaCl溶液(CuCl2) | 钠 | 结晶 |
| B | S02(SO3) | NaOH溶液 | 萃取 |
| C | Cu(NO3)2溶液(AgNO3) | 铜粉 | 分液 |
| D | 乙醇(水) | … | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| B. | 在含大量Al3+的溶液中:Na+、K+、AlO2-、NO3- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、HCO3-、Cl-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com