
| A. | 氯分子的电子式: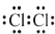 | B. | 氯离子(Cl-)的结构示意图: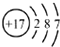 | ||
| C. | 中子数为20的氯原子: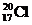 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
分析 A.氯气只含Cl-Cl,均满足8电子稳定结构;
B.氯离子(Cl-)的核外电子为18;
C.质量数为17+20=37;
D.氯乙烯中含碳碳双键.
解答 解:A.氯气只含Cl-Cl,均满足8电子稳定结构,电子式为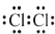 ,故A正确;
,故A正确;
B.氯离子(Cl-)的核外电子为18,离子结构示意图为 ,故B错误;
,故B错误;
C.质量数为17+20=37,则该氯原子为${\;}_{17}^{37}$Cl,故C错误;
D.氯乙烯中含碳碳双键,氯乙烯分子的结构简式为CH2=CHCl,故D错误;
故选A.
点评 本题考查化学用语,为高频考点,把握电子式、结构示意图、结构简式的规范使用等为解答的关键,侧重分析与应用能力的考查,注意化学用语的规范性,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
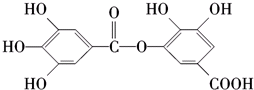
| A. | 常温下 可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5 mol 该物质完全反应可以消耗4 mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g | |
| B. | 1molC5H12分子中碳碳之间共用的电子对数为5NA | |
| C. | 电解Na2SO4溶液,在阴极区增加2molH+ 时消耗电子数为2NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,放出46kJ热量转移电子数3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
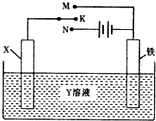
| A. | 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法 | |
| B. | 若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变 | |
| C. | 若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小 | |
| D. | 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
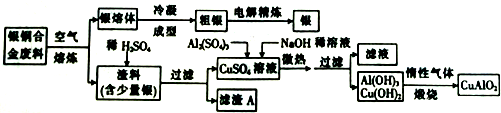
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com