
| A. | A是原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A与酸反应置换出的H2比1mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
分析 比较金属的活泼性,可从对应元素的金属性强弱、对应最高价氧化物的水化物的碱性强弱、与水或酸反应的剧烈程度以及金属活动顺序表、形成原电池中的正负极等进行分析判断.
解答 解:A、金属的活泼性取决于失电子的能力,而与主族序数无关,如Mg的族序数为2,Na的族序数为1,但Na较Mg活泼,故A错误;
B、金属的活泼性取决于失电子的能力,而与周期序数无关,如Cu为第四周期,Na为第三周期,但是活泼性Na大于Cu,故B错误;
C、金属的活泼性与从酸中置换出的H2多少无关,如1molAl可置换出1.5molH2,1molNa可置换出0.5molH2,但Na活泼,故C错误;
D、把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡,则A为负极,B为正极,活泼性负极大于正极,故D正确;
故选D.
点评 本题考查金属活泼性的比较,难度不大,注意金属的强弱只与失电子能力有关,而与原子失电子多少、原子的电子层数无关.


科目:高中化学 来源: 题型:多选题
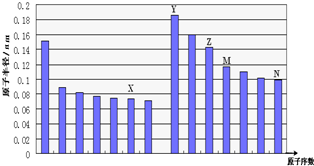
| A. | N、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 | |
| D. | X与Y两种元素组成的一种化合物中阴、阳离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者都能水解,且水解的最终产物相同 | |
| B. | 它们都可用(C6H10O5)n表示,所以二者互为同分异构体 | |
| C. | 它们均属于糖类,都具有甜味,且都是高分子化合物 | |
| D. | 淀粉能发生银镜反应,而纤维素不能,但能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
 、
、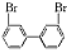 、
、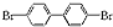 ;
;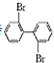 与
与 的相互关系是B.
的相互关系是B.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 1mol | C. | 0mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
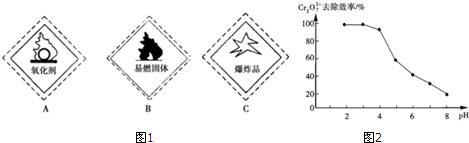
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com