
某状况下,2g 二氧化碳气体的体积是 1120 mL,2g A 气体的体积是 770 mL,A的摩尔质量是__________。 某金属氯化物 MCl2 40.5 g 含 0.6 mol Cl-,则该氯化物的摩尔质量为__________,金属M的相对原子质量为__________。
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:阅读理解
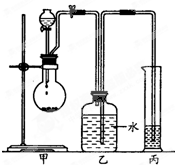 某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.
某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.| 实验编号 | 有机样品的体积 | 有机样品的质量 | 生成气体的体积(标准状况下) | I | 3.65mL | 3.8g | 1120mL | II | 7.30mL | 7.6g | 2240mL | III | 14.60mL | 15.2g | 4000mL |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 )和某合成鞣剂(
)和某合成鞣剂(  )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)





 ,X的结构简式为
,X的结构简式为



查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州中学高三12月质量检测化学试卷(带解析) 题型:填空题
(15分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.分解天然气 |

 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1 CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= 
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三12月质量检测化学试卷(解析版) 题型:填空题
(15分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.分解天然气
(2)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线 。该反应为 (放热还是吸热)反应

(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量写出其完全燃烧的热化学方程式: 。
(4)利用氢气和CO合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g) + CO2
(g)的ΔH=
CH3OCH3(g) + CO2
(g)的ΔH=
(5)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:

①氢氧燃料电池中,正极的电极反应式为 。
②上图装置中,某一铜电极的质量减轻3.2g,则 a 极上消耗的O2在标准状况下的体积为
L。
(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极电极方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com