
����Ŀ����100��ʱ����0.200mol�������������������2L��յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ����ʽ��з������õ����±���
ʱ�䣨S�� | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� mol | 0.200 | c1 | 0.10 | c3 | a | b |
n��NO2�� mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
����գ�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2���ﵽƽ��ʱ������������ת����Ϊ ��
��3��20sʱ������������Ũ��c1=molL��1 ��
��4����0��20sʱ����ڣ�����������ƽ����Ӧ����Ϊ ��
���𰸡�
��1��N2O4��g��?2 NO2��g��
��2��60%
��3��0.07
��4��0.003mol/��L��s��
���������⣺��1���������֪����Ӧ����������������������������������ԭ���غ�ø÷�Ӧ����ʽΪ N2O4��g��2 NO2��g�������Դ��ǣ�N2O4��g��2 NO2��g������2�����ݱ�֪��60sʱ�÷�Ӧ�ﵽƽ��״̬������n��NO2��=0.240mol����μӷ�Ӧ��n��N2O4��= ![]() n��NO2��=
n��NO2��= ![]() ��0.240mol=0.120mol��������������ת����=
��0.240mol=0.120mol��������������ת����= ![]() ��100%=
��100%= ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�60%����3��20sʱ������n��NO2��=0.120mol����μӷ�Ӧ��n��N2O4��= ![]() n��NO2��=
n��NO2��= ![]() ��0.120mol=0.060mol��ʣ���n��N2O4��=0.200mol��0.060mol=0.140mol��c��N2O4��=
��0.120mol=0.060mol��ʣ���n��N2O4��=0.200mol��0.060mol=0.140mol��c��N2O4��= ![]() =
= ![]() =0.07mol/L��
=0.07mol/L��
���Դ��ǣ�0.07�� ��4����0��20sʱ����ڣ�����������ƽ����Ӧ����= ![]() =
= ![]() =0.003mol/��L��s����
=0.003mol/��L��s����
���Դ��ǣ�0.003mol/��L��s����
�����㾫�������ջ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������м��Լ��ͷǼ��Լ�����(����)
A.CH4��SiF4
B.H2O2��N2H4
C.NaOH��NH4Cl
D.C2H6��HCOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʹ�����Ϊԭ�ϵ���������ɿڣ�ͨ����̼�����������ɼ�����Ϊ�������ȶ��Բ��������ζ�۲���������̼���ṩ�����ӡ����к������ǣ� ��
A.�ڢ�B.�٢�C.�٢�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݣ�
�����ø�Ũ�������Ƴ�1mol/L��ϡ���ᣮ
��ʵ���ҽ���Ҫ����ϡ����220mL���Իش���������
��1������Ͳ��ȡ��Ũ����mL��
��2������ʱ������ʹ�õ���������Ͳ���ձ����������⣬��ȱ�ٵ���������
��3��������Һ�Ĺ����У�������������ȷ�����в�����ʹ������ҺŨ
��ƫ�ߵ�����
A.����Ͳ��ȡŨ����ʱ����
B.ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
C.��ȡŨH2SO4�����Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
D.����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ����Һ����ʹ���̶�������
E.����ƿ������
F.����ʱ����������ƿ�̶���
��4����������0.1mol/LNaOH��Һ450mL��
�ٸ��ݼ����֪������NaOH������Ϊg��
������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ� ��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע��500mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ������ݸ�ʾ��ͼ���������Ŀ�� 
��1�����ʣ��׳���װ�ã��ҳ���װ�ã�
��2���ڼ׳��У�ͨ��C2H4�ĵ缫������ �� ͨ��O2�ĵ缫�ĵ缫��Ӧʽ�� �� �׳��з����ķ�Ӧ�Ļ�ѧ����ʽΪ ��
��3�����ҳ��У�B��ʯī���缫�������� �� A��Fe���缫�ĵ缫��ӦʽΪ ��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ ��
��5�����ҳ���A��Fe��������������5.40gʱ���׳�������������O2mL����״���£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����������H+��Na+��Al3+��Ba2+��OH����Cl����HCO3�������е�������ɣ����Է�����ͼת��������˵����ȷ���ǣ� �� 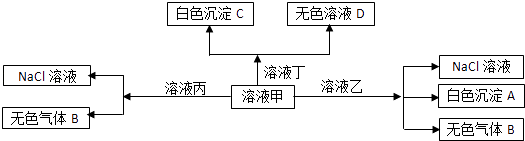
A.��ΪAlCl3 �� ��ΪNaHCO3
B.��Һ���л����Դ�������������У�Fe2+��NO3����SO42��
C.�ڼ��еμӶ���ʼ��Ӧ�����ӷ���ʽ��HCO3��+Ba2++OH��=BaCO3��+H2O
D.��ɫ����A�����ܽ�����ҺD��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬλ�س�������������ָʾ����ж�ͬλ�ص�˵����ȷ���ǣ� ��
A.34Sԭ�Ӻ��ڵ�������Ϊ16B.16O�� 18O�ĺ˵�������
C.13C��15Nԭ�Ӻ��ڵ����������2D.2H+������1H+��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ��ҹ�����̽����ǧ����������Ȼ�����Ȼ������Ҫ�ɷ�Ϊ
A. H2B. CH4C. CO2D. NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO2��Һ�ڲ�ͬ�¶��¾��ɱ�����KlO3��������NaHSO3��ȫ���ļ���I2����������I2��������ʱ��������NaHSO3�ķ�Ӧ���ʣ���Ũ�Ⱦ�Ϊ0.020 molL��1��NaHSO3��Һ�����������ۣ�10.0 mL��KIO3��������������Һ40.0 mL��ϣ���¼10��55�����Һ����ʱ�䣬55��ʱδ�۲쵽��Һ������ʵ������ͼ����ͼ�����������жϲ���ȷ���ǣ� �� 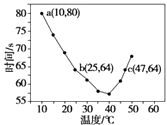
A.40��֮ǰ��40��֮����Һ������ʱ�����¶ȵı仯�����෴
B.ͼ��a���Ӧ��NaHSO3��Ӧ����Ϊ5.0��10��5 molL��1s��1
C.ͼ��b��c�����Ӧ��NaHSO3��Ӧ�������
D.40��֮���۲���������ʵ���ָʾ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com