
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
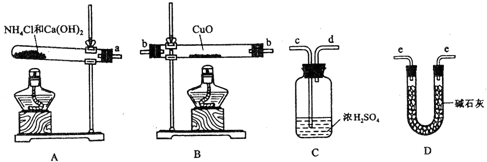
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
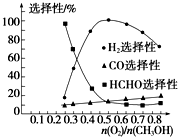
| n(O2) |
| n(CH3OH) |
| n(O2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
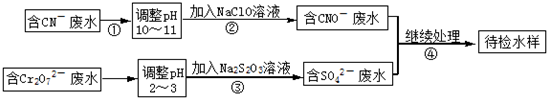
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、居室内空气中存在的污染物主要来自于装修材料、日用化学品、香烟烟雾以及家用燃料的燃烧产物等 |
| B、燃料不完全燃烧产生的一氧化碳也是一种室内污染物 |
| C、在居室内放置几盒花草就可消除室内空气污染 |
| D、预防装修污染,最重要的是选择经过严格检测的、环保的装修材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、mol/L |
| B、mol/L |
| C、2.5dmol/L |
| D、1.25dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
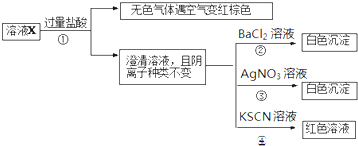
| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com