
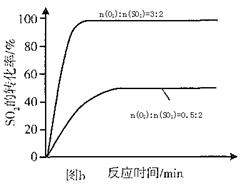
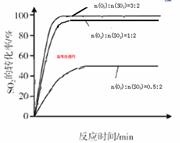
 2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |



科目:高中化学 来源:不详 题型:单选题
 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.4×10—5 | B.4.5×10—4 | C.0.015 | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
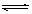 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是| A.3υ正 (N2)=υ正 (H2) | B.υ正 (N2)=υ逆 (NH3) |
| C.2υ正 (H2)=3υ逆 (NH3) | D.υ正 (N2)=3υ逆 (H2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 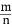 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ur- + H3O+ ②Ur- (aq)+Na+(aq)
Ur- + H3O+ ②Ur- (aq)+Na+(aq)  NaUr(s)
NaUr(s)| A.反应的△H>0 | B.反应的△H<0 |
| C.升高温度平衡向正反应方向移动 | D.改变温度不影响平衡移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于P% | B.大于P% | C.小于P% | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度控制在500℃有利于合成氨反应 |
| B.用排饱和食盐水法收集Cl2 |
| C.打开碳酸饮料会有大量气泡冒出 |
| D.在硫酸工业生产中使用过量的氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com