
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②⑤ |
分析 ①NaHCO3溶液加水稀释,促进HCO3-的水解,溶液中碳酸氢根离子浓度减小;
②根据碳酸钠、碳酸氢钠混合液中的物料守恒判断;
③二者恰好完全中和生成氯化铵,为强酸弱碱盐,水解呈酸性;
④亚硫酸钠溶液中加入氢氧化钠,钠离子浓度增大,同时氢氧根离子浓度增大抑制了亚硫酸根离子的水解,导致亚硫酸根离子浓度也增大;
⑤根据Na2CO3溶液中的电荷守恒判断.
解答 解:①NaHCO3溶液加水稀释,促进HCO3-的水解,n(HCO3-)减小,n(Na+)不变,则$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值会增大,故①正确;
②浓度均为0.1mol•L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,而c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,则:2c(Na+)═3[c(CO32-)+c(H2CO3)+c(HCO3-)],故②错误;
③在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和生成氯化铵,铵根离子水解促进了水的电离,此时pH=a,则溶液中水电离的c(OH-)=c(H+)=10-amol•L-1,故③正确;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,溶液中钠离子、氢氧根离子浓度增大,氢氧根离子抑制了亚硫酸根离子的水解,则亚硫酸根离子浓度增大,所以c(Na+)、c(SO32-)均增大,故④正确;
⑤在Na2CO3稀溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故⑤错误;
根据分析可知,错误的有②⑤,
故选D.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题.


科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: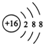 | B. | 纯碱的化学式:NaOH | ||
| C. | 原子核内有8个中子的氧原子:188O | D. | 氯化镁的电子式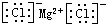 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
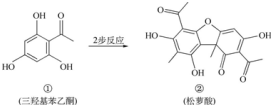
| A. | 有机物①的分子式为C8H6O4 | |
| B. | 有机物①在一定条件下能发生取代、加成和氧化反应 | |
| C. | 可用FeCl3溶液检验②中是否含有杂质① | |
| D. | 相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | 若将两种酸溶液等体积混合,混合溶液的pH一定等于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 NaOH KCl | B. | KCl Na2CO3 Na2SO4 | ||
| C. | BaCl2 NaCl Na2SO4 | D. | NaCl AgNO3 KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
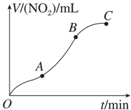
| A. | OA段表示开始时,反应速率稍慢 | |
| B. | AB段表示反应速率较快,一定因为产物有催化作用 | |
| C. | BC段表示随时间增加,反应速率逐渐增大 | |
| D. | BC段表示反应速率最快,在该时间段内收集到的气体最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加铁的量 | B. | 加热 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com