
1升0.1mol/L氨水所含溶质微粒的物质的量是
A.0.1molNH3分子
B.0.1molNH3•H2O分子
C.NH3分子和NH3•H2O分子共0.1mol
D.NH3分子、NH3•H2O分子和NH4+共0.1mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年浙江省宁波市高一下学期学考期中化学试卷(解析版) 题型:选择题
有关苯的结构和性质,下列说法正确的是
A. 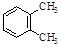 与
与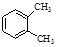 是同分异构体
是同分异构体
B. 苯在空气中不易燃烧完全,燃烧时冒浓烟
C. 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D. 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下学期选考期中化学试卷(解析版) 题型:选择题
下列每组物质发生各自变化所克服的微粒间的相互作用属同种类型是
A、食盐和蔗糖的熔化
B、白磷和硫的熔化
C、氯化铵固体和干冰受热后的气化
D、氧化镁和金属镁的熔化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
甲和乙两烧杯中各装有100 mL 0.2 mol·L-1AlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下列判断正确的是
A.实验过程中甲中和乙中的现象始终保持一致
B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的多
D.乙中沉淀可能比甲中的多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是
A.0.1 mol NH5中含有5 mol N—H键
B.NH5的熔沸点高于NH3
C.NH5固体投入少量水中,可产生两种气体
D.NH5中既有离子键又有共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是
A.铜和稀硝酸反应 B.汽车发动机中氮气和氧气发生反应
C.二氧化氮气体溶于水 D.氨的催化氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:填空题
(1)下列微粒: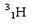 、
、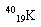 、
、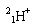 、
、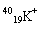 、
、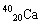 、
、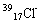 、
、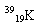 中有______种元素,有 种核素,其中__________________互为同位素。
中有______种元素,有 种核素,其中__________________互为同位素。
(2)AXn+共有x个电子,该阳离子的中子数为N,则N=____________________。
(3)下列物质中Na2O、CO2、CaCl2、H2O2、Ca(OH)2、Na2O2、NH4Cl属于含非极性键的共价化合物的是_________。
(4)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①第ⅣA族元素的最外层电子数______;
②第三周期元素的最高化合价______;
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:推断题
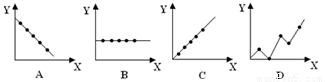
有机物J的分子式为C10H12O3,是一种重要的化工原料,可用作溶剂、催化剂、塑料助剂以及合成医药、农药等。目前,我国有关 J的用途是作为农药胺硫磷、甲基异柳磷的中间体。下图是这种有机物的合成方案:
已知:有机物I中有两个化学环境相同的甲基。
请回答下列问题:
(1)写出下列反应的反应类型:①___________,③_____________。
(2)写出反应④的化学方程式:_____________________。
(3)J的结构简式为_____________。
(4)反应①所起的作用是_____________。
(5)H的核磁共振氢谱共有________组吸收峰,其面积之比为____________。
(6)下列有关E的性质说法,正确的是____________。
a.能使酸、碱指示剂变色
b.能使FeCl3溶液显色
c.与纯碱溶液混合无现象
d.难溶于水
e.1ml该有机物与足量钠反应可产生标况下氢气22.4L
(7)满足下列条件且与有机物J互为同分异构体的有机物共有_______种,任写出其中一种的结构简式_______________________________。
A.苯环上仅有两个对位取代基
B.能发生水解反应
C.遇浓溴水能发生反应
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:实验题
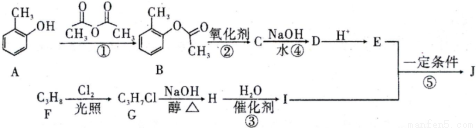
钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
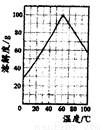
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com