
| 序号 | x值 | y=f(x) |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
| 2 |
| 3 |
| 2 |
| 3 |
| 序号 | x取值 | y=f(x) | ||
| ① | 0<x≤3 | y=
| ||
| ② | 3<x<3.2 | y=32-10x |


科目:高中化学 来源: 题型:
| A、分液时下层液体从分液漏斗下端放出,上层液体从上口倒出 |
| B、酸碱滴定实验中,酸式滴定管装液前不必先用待装溶液润洗 |
| C、蒸馏过程中,冷却水从冷凝管的上端通入 |
| D、配制一定物质的量浓度的溶液时,直接将称取的固体药品倒入容量瓶加水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给烧瓶加热必须使用石棉网 |
| B、制取蒸馏水的装置温度计要插入加热的水中 |
| C、分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗上的小孔 |
| D、振荡分液漏斗中的溶液时,要一只手按住口部,另一只手握住活塞部分颠倒振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
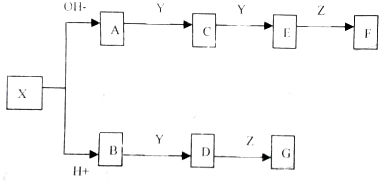
查看答案和解析>>
科目:高中化学 来源: 题型:
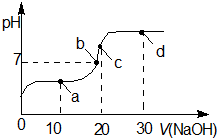 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的醋酸和盐酸中和氢氧化钠的量一定相同. |
| B、PH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10 mol.L-1 |
| C、相同浓度的下列溶液:①CH3COONH4 ②CH3COONa ③CH3COOH中,c(CH3COO)由大到小的顺序是②>①>③ |
| D、0.1mol.L-1 NaHCO3溶液中c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
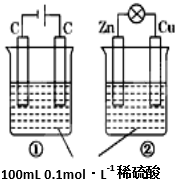
| 选择 | 叙述 | 评价 |
| A | 装置名称:①是电解池,②是原电池 | 错误 |
| B | 硫酸浓度变化:①增大,②减小 | 正确 |
| C | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:Zn-2e-═Zn2+ | 正确 |
| D | 离子移动方向:①中H+向阴极方向移动 ②中H+向正极方向移动 | 错误 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com