
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()

A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
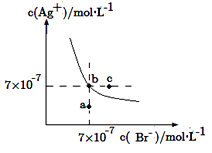
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________。
(2)V、W、X的原子半径由小到大的顺序是______________________。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | N(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() molL-1min
molL-1min
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是草酸溶液中![]() 、
、![]() 三种微粒的分布分数
三种微粒的分布分数![]() 某微粒物质的量浓度与三种微粒物质的量被度和的比值
某微粒物质的量浓度与三种微粒物质的量被度和的比值![]() 与pH的关系图,下到有关说法不正确的是
与pH的关系图,下到有关说法不正确的是![]()
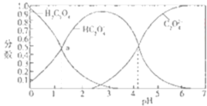
A.![]() 的溶液中
的溶液中![]()
B.![]() 溶液中:
溶液中:![]()
C.向![]() 溶液中加强酸至pH与a点对应时,溶液中
溶液中加强酸至pH与a点对应时,溶液中![]()
D.为使溶液中![]() 尽可能多一些,溶液的pH最好控制在
尽可能多一些,溶液的pH最好控制在![]() 左右
左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为 2Ag+Cl2═2AgCl。
(1)写出该电池工作时的两极反应:负极:___;正极:___。
(2)当电路中转移amole﹣时,交换膜左侧溶液中约减少___mol离子;交换膜右侧溶液c(HCl)___(填“>”“<”或“=”)1molL-1(忽略溶液体积变化)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左下图所示,用Cu—Si合金作硅源,在950℃下利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(如下图所示)作为电源。下列有关说法不正确的是

A. 电极c与b相连,d与a相连
B. 左侧电解槽中;Si优先于Cu被氧化
C. a极的电极反应为CH4-8e—+4O2— ===CO2+2H2O
D. 相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。
(1)HA是_____(填“强电解质”或“弱电解质”,下同),BOH是____。
(2)HA的电离方程式是____、BOH的电离方程式是______。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_____(填字母)。
A.![]() B.
B.![]() C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体____(填“多”、“少”或“相等”)。
Ⅱ. 在25 ℃时,请进行有关计算:(已知lg2=0.3)
(5)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水___mL;如果加入pH=4的HCl溶液,需加入此HCl溶液____ mL(假定溶液体积有加和性,下同)。
(6)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=____。
(7)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=_____。
(8)pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.己知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.单质中不可能含有离子键
D.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com