
科目:高中化学 来源: 题型:阅读理解

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却 冷却 过滤 过滤 |
得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, 滴入适量的硝酸酸化的AgNO3溶液 滴入适量的硝酸酸化的AgNO3溶液 |
生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, 加热使其融化,测其熔点 加热使其融化,测其熔点 |
熔点为122.4℃ 熔点为122.4℃ |
白色晶体是苯甲酸 |
| 2.4×10-3mol×4×122g/mol |
| 1.22g |
| 2.4×10-3mol×4×122g/mol |
| 1.22g |
查看答案和解析>>
科目:高中化学 来源: 题型:
(分)高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,

⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3 少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是: (a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省兰州一中高二下学期期末考试化学试卷(带解析) 题型:填空题
甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理: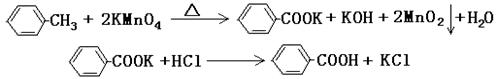
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, , | 得到白色晶体和无色溶液 |  |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源:吉林省模拟题 题型:实验题

(1)①在次氯酸钠溶液中加入固体烧碱形成碱性环境。
①将研磨后的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。该反应的离子方程式为_______________________。
②将KOH加入到反应后的溶液中搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为______________________;推测该反应发生的理由是______________________。
④依次用甲苯、乙醇、乙醚洗涤以除去水分和KNO3、KCl、KOH等杂质。
(2)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价格)。现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液和稍过量的KCrO2,充分反应后,转移到250mL容量瓶中,定容。量取25.00mL溶液,用稀硫酸酸化后,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,共用去标准溶液33.33mL。
①用离子方程式表示标准溶液显酸性的原因:____________________。
②用离子方程式表示上述滴定反应原理:______________________;如果滴定过程中,剧烈振荡,会使部分亚铁离子被空气中的氧气氧化,导致实验结果偏低。写出亚铁离子在酸性条件下被空气中氧气氧化的离子方程式:______________________。
③上述实验制得的样品中高铁酸钾的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)
1.将尿素与钠分散液在60~110℃发生反应,然后加热(140~200℃)可制备NaCNO。该方法同氧化法相比,能够制备较纯净的氰酸盐。写出反应方程式。
2.含某化合物的较浓的溶液中加入少量的AgNO3溶液出现白色沉淀,然后滴加几滴浓NaOH溶液,振荡后沉淀立即溶解。写出反应方程式。
3.用Mn2O3/H2SO4直接氧化法将对溴甲苯氧化对溴苯甲醛是一条绿色工艺流程,写出反应方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com