
【题目】I.现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是____________(填序号)
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)___________________
II.(1)物质的量浓度相同的 ①氯化铵;② 碳酸氢氨;③ 硫酸氢氨; ④硫酸氨4种溶液中,c(NH4+)由大到小的顺序是___________
(2)请写出明矾做净水剂净水时的离子方程式_________________
(3) CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(4) 等物质的量浓度的下列物质的溶液:①NaCl②CH3COONa ③NH4Cl ④AlCl3 ⑤Ba(OH)2 ⑥Na2CO3 ⑦NaHCO3 ⑧NaHSO4 ⑨NaOH ⑩H2SO4 pH值由大到小的顺序是 (填序号)
【答案】I.(1) ①②③④ ②④⑥;
(2)HCO3-+H2O ![]() H2CO3+OH-
H2CO3+OH-
II.(1) ④> ③> ①>②;
(2)Al3++3H2O![]() Al(OH)3+3H+.
Al(OH)3+3H+.
(3)bcf;
(4)⑤⑨⑥⑦②①③④⑧⑩;
【解析】
试题分析:I.(1)①Na2CO3是盐,属于强电解质,只能与盐酸反应;②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;③HCl属于强酸,是强电解质;④NH4HCO3属于盐,既能与酸反应生成二氧化碳气体,又能与碱反应生成氨气;⑤C2H5OH属于非电解质;⑥Al既能跟NaOH溶液反应,又能跟盐酸反应;⑦食盐水属于混合物;⑧CH3COOH是弱酸,属于弱电解质,故答案为:①②③④;②④⑥;
(2)碳酸氢钠属于强碱弱酸盐,水解呈碱性,离子反应方程式为:HCO3-+H2O=H2CO3+OH-,故答案为:HCO3-+H2O=H2CO3+OH-;
II. (1)硫酸铵中铵根离子个数是2,所以硫酸铵中铵根离子浓度最大,碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以氯化铵、碳酸氢铵、硫酸氢铵中铵根离子浓度大小顺序是③>①>②,则相同浓度的这几种溶液中c(NH4+)的由大到小顺序是④>③>①>②,故答案为:④>③>①>②;
(2)明矾做净水剂净水时的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,故答案为:Al3++3H2O
Al(OH)3+3H+,故答案为:Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(3)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;a.加入少量0.10molL-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;c.加水稀释至0.010molL-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误; f.加入少量0.10molL-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;故选bcf;
(4)①NaCl ②CH3COONa ③NH4Cl ④AlCl3 ⑤Ba(OH)2 ⑥Na2CO3⑦NaHCO3⑧NaHSO4⑨NaOH ⑩H2SO4,属于碱的为:⑤Ba(OH)2 ⑨NaOH,浓度相同时,碱性及pH为⑤>⑨;水解呈碱性的为:②CH3COONa,⑥Na2CO3,⑦NaHCO3 依据水解程度大小分析,则pH:⑥>⑦>②;溶液呈中性的为:①NaCl;溶液呈酸性的有:③④⑧⑩,其中③NH4Cl④AlCl3溶液中铵根离子铝离子水解显酸性,铝离子水解程度大于铵根离子,⑧NaHSO4 溶液中完全电离相当于一元强酸,⑩为二元强酸,浓度相同时,溶液的pH:⑩<⑧<④<③,综合以上分析可知,溶液的pH由大到小的顺序是为:⑤⑨⑥⑦②①③④⑧⑩,故答案为:⑤⑨⑥⑦②①③④⑧⑩。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
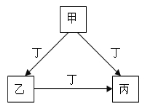
【题目】甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙不可能是( )
A.Al(OH)3 B.FeCl3
C.CO D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述不正确的是
A. 明矾可以对自来水杀菌
B. 在医疗上碳酸氢钠可用于治疗胃酸过多
C. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1) 该反应的化学平衡常数表达式为K=__________,该反应为_________反应(填吸热或放热)。
若改变条件使平衡向正反应方向移动,则平衡常数_____________(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2) 能判断该反应是否达到化学平衡状态的依据是_______________
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3) 将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应 CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),得到如下三组数据:
CO2 (g) + H2 (g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①通过计算可知,CO的转化率实验A 实验B(填“大于”、“等于”或“小于”),该反应的正反应为 (填“吸”或“放”)热反应。
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是 (用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变
③各气体组分浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是 ( )
A.①②⑤ B.③④⑤ C.⑥⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由乙烯生成乙醇属于加成反应 B. 含碳元素的化合物都是有机物
C. 乙酸的酸性比碳酸弱 D. 乙烷室温下能与浓盐酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是
A.用pH试纸测双氧水的pH
B.用托盘天平称取 5.85 g NaCl晶体
C.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
D.用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com