
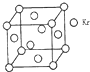
 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字). 分析 Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之相邻的Kr原子处于面心,每个顶点点Kr原子为8个晶胞共有,每个面心Kr原子为2个晶胞共用,结合均摊法计算.
解答 解:Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之相邻的Kr原子处于面心,每个顶点点Kr原子为8个晶胞共有,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有$\frac{3×8}{12}$=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则m:n=12:4=3,故答案为:3.
点评 本题考查晶胞计算,注意利用均摊法计算解答,需要学生具有一定的空间想象,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl晶体与Ba(OH)2•8H2O反应 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 硝酸铵溶于水 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们的物质的量相等时,跟足量的盐酸反应,在相同状况时放出的CO2体积相同 | |
| B. | 它们的物质的量相等时,跟足量的盐酸反应,所消耗盐酸的物质的量相同 | |
| C. | 它们的物质的量相等时,在水中电离出相同数目的Na | |
| D. | 它们的物质的量相等时,与足量盐酸反应产生物质的量相等的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
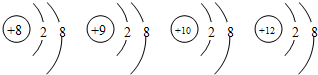 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | 它们属于不同元素 | |
| B. | 它们都是离子 | |
| C. | 它们的最外层都具有稀有气体原子的稳定结构 | |
| D. | 它们的核外电子排布均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先①后② | B. | 先②后① | C. | 先②后③ | D. | 先③后② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com