
【题目】下列仪器在使用之前需要检查是否漏液的是( )
①分液漏斗 ②长颈漏斗 ③容量瓶 ④量筒 ⑤洗气瓶.
A.①③B.①③⑤C.①②③D.①②③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
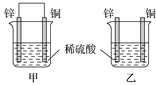
A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的 SO2 和 SO3 相比较,下列结论错误的是
A. 它们的分子数目之比是 1∶1
B. 它们的氧原子数目之比为 2∶3
C. 它们的质量之比为 1∶1
D. 它们所含原子数目之比为 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:![]()
![]()
![]()
![]() N2
N2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.6mol氧气的空气(忽略CO2),放入0.5 L 恒温恒容的密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),测得n(O2)随时间的变化如下表:
2SO3(g),测得n(O2)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | a | a | a |
反应达到5s 后,将容器中的混合气体通入过量的NaOH溶液,气体体积减少了22.4L(已折算为标准状况,忽略吸收O2);再将剩余气体通入过量焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(已折算为标准状况)。请回答下列问题:
(1)用SO2表示从0~1s内该反应的平均反应速率为_______。
(2)反应前容器中SO2的浓度为_______。
(3)混合气体通入过量的NaOH溶液,发生反应的离子方程式为_______。
(4)4s~5s 时,下列说法正确的是_______(填字母)。
A.SO2的生成速率等于O2的消耗速率
B.SO2与O2的浓度比不变
C.混合气体的平均相对分子质量不变
D.该反应已停止
(5)该反应达到平衡时SO2的转化率是_______ (用百分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用CO2与NH3为原料合成尿素[CO(NH2)2],反应原理为:
①2NH3 +CO2=H2NCOONH4; ②H2NCOONH4=CO(NH2)2 + H2O
(1)将一定量![]() =3的原料气通入合成塔中,在分离出的气体中测得
=3的原料气通入合成塔中,在分离出的气体中测得![]() =6,则该反应中CO2的转化率(CO2转化率=
=6,则该反应中CO2的转化率(CO2转化率=![]() ×100%)为______。
×100%)为______。
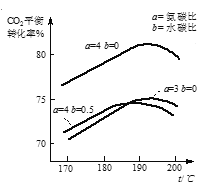
(2)合成中氨碳比[![]() ]、水碳比[
]、水碳比[![]() ]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。
]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。
(3)实验室用以下装置模拟第一步反应合成H2NCOONH4(氨基甲酸铵)的实验。
已知:H2NCOONH4遇水易发生非氧化还原反应,生成碳酸铵或碳酸氢铵。
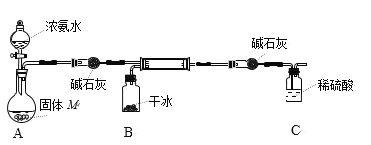
①装置A用于制备氨气,则固体M可以是______或______。
②反应中若有水存在,写出生成碳酸氢铵反应的化学方程式______。
③选用干冰提供CO2的优点是______。装置C为吸收尾气的装置,导管未插入液面以下的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子中质子、中子、电子的数量、质量和电性之间存在一定的相互关系。请填写下列空白:
(1)质子数决定________的种类;质子数和中子数决定________的种类。
(2)![]() 代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
(3)质量数=________+________,对任一原子,核电荷数=________;对中性原子,核外电子数=________。
(4)ZXn-中核外电子数=________,ZXn+中核外电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:_________________________________。若反应中生成0.2molHNO3,转移的电子数为__________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是(写出2点)________________________、_____________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com