
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
分析 A.氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
B.电离生成的阳离子全部是氢离子的化合物是酸;
C.电离生成的阴离子全部是氢氧根离子的化合物是碱;
D.能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐.
解答 解:A.Na2O和Na2O2都是只含有两种元素,且其中一种元素是氧元素的化合物,属于氧化物,故A不选;
B.H2SO4和CH3COOH是电离生成的阳离子全部是氢离子的化合物,属于酸,故B不选;
C.烧碱为氢氧化钠属于碱,纯碱为Na2CO3是由钠离子和碳酸根离子形成的化合物,属于盐,故C选;
D.Na2CO3是由钠离子和碳酸根离子形成的化合物,属于盐,NaHCO3是由钠离子和碳酸氢根离子形成的化合物,属于盐,故D不选;
故选C.
点评 本题考查了酸、碱、盐、氧化物的概念,题目难度不大,注意这几个概念的区别.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
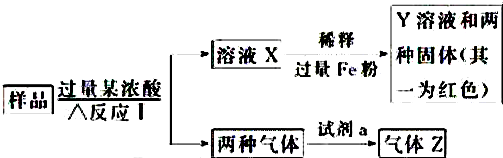
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
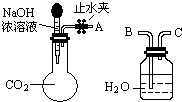 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
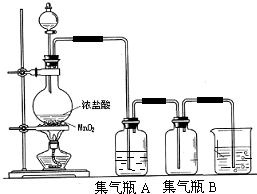 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的吸氧腐蚀和析氢腐蚀的正极反应式均为:Fe-2e-═Fe2+ | |
| B. | 钢铁发生吸氧腐蚀时,负极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 地下钢管连接镁块防腐的方法为“牺牲阳极的阴极保护法” | |
| D. | 钢铁发生吸氧腐蚀时,钢铁制品的质量一定减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
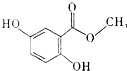
| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com