
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
分析 A.盖斯定律是变化过程中能量变化和途径无关,与反应物和生成物能量有关,是能量守恒的体现;
B.浓硫酸溶于水放热;
C.能量越低越稳定;
D.2g氢气为1mol,热化学方程式中反应热数据错误.
解答 解:A.盖斯定律是变化过程中能量变化和途径无关,与反应物和生成物能量有关,可以看作是能量守恒的体现,故A正确;
B.浓硫酸溶于水放热,如稀溶液:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则浓硫酸反应生成1mol水放出的热量大于57.3kJ,故B正确;
C.由C(石墨)-→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石的能量低,能量越低越稳定,故C正确;
D.2g氢气为1mol,热化学方程式中反应热数据错误,应为△H=-571.6 kJ/mol,故D错误.
故选D.
点评 本题考查化学反应与能量的变化,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握反应热的计算、比较方法,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:200 | B. | 200:1 | C. | 100:1 | D. | 1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
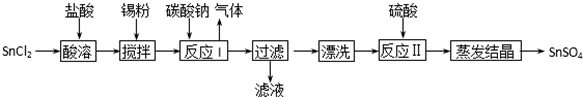
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验目的 | 实验操作 | 现象 | 结论 |
| 自来水中离子检验 | 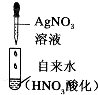 | 出现不溶于稀HNO3的沉淀 | 自来水中含氯离子 |
| 水的提纯 | 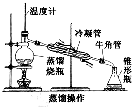 | 蒸馏烧瓶中水沸腾,冷凝管中有无色液体凝结,并通过冷凝管流入锥形瓶中 | 锥形瓶中收集到无色液体 |
| 蒸馏水中杂质离子的检验 | 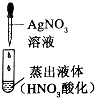 | 无明显现象 | 蒸馏水中不含氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com