
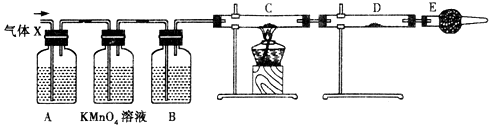
分析 浓硫酸具有强氧化性,能被金属还原生成二氧化硫,则Zn和浓硫酸发生氧化还原反应生成硫酸锌、二氧化硫和水,发生Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
随着反应的进行,浓H2SO4 浓度逐渐变稀,Zn与稀H2SO4 反应可产生H2,A为品红,可用于检验二氧化硫,B为浓硫酸,可用于干燥氢气,C为CuO,可检验氢气,D为无水硫酸铜,可检验水的生成,E为碱石灰,可防止空气中的水进入,以干扰实验现象,以此解答该题.
解答 解:(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(2)反应时浓H2SO4 浓度逐渐变稀,Zn与稀H2SO4 反应可产生H2,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
故答案为:当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
(3)装置是气体验证食盐,所以需要装置气密性完好,实验开始先检验装置的气密性,
故答案为:检查装置的气密性;
(4)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中 的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,
故答案为:品红溶液;检验SO2; 浓H2SO4;吸收水蒸气;碱石灰;防止空气中的水蒸气进入D中;
(5)证明生成的气体中含有水蒸气的现象,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色,如果去掉装置B,混合气体中含H2O,会干扰H2的检验,则不能去掉B装置,
故答案为:黑色固体变成红色;白色粉末变成蓝色;不能;因为混合气体中含H2O,会干扰H2的检验.
点评 本题考查性质实验方案设计,为高频考点,侧重考查学生实验基本操作、物质的性质、物质的检验等知识点,同时还考查学生思维的严密性,明确实验原理是解本题关键,知道每个装置的作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 热交换器 | B. | 沸腾炉 | C. | 吸收塔 | D. | 接触室 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 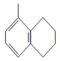 所有碳原子可能在同一平面上 所有碳原子可能在同一平面上 | |
| B. | 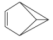 的一氯代物有4种 的一氯代物有4种 | |
| C. |  的命名为2,3-二甲基-l-丙醇 的命名为2,3-二甲基-l-丙醇 | |
| D. | 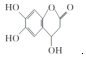 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
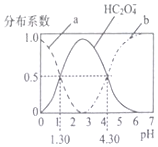 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )| A. | 曲线a代表H2C2O4,曲线b代表C2O42- | |
| B. | 常温下0.1mol/L的NaHC2O4溶液显酸性 | |
| C. | 常温下,H2C2O4的电离平衡常数Ka2=10-4..30 | |
| D. | pH从1.30~4.30时,$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$先增大后减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com