
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
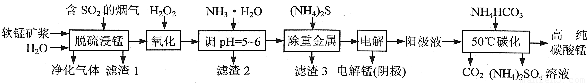
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为??????? 。
(2)“滤渣2”中主要成分的化学式为??????? 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是??????? 。
(4)“电解”时用惰性电极,阳极的电极反应式为??????? 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为??????? 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3;??????? ;??????? 。
(1)MnO2+SO2=MnSO4
或H2O+SO2? =H2SO3、MnO2+H2SO3=MnSO4+H2O(2分)
(2)Fe(OH)3、Al(OH)3(2分)
(3)Na2S会增大回收的(NH4)2SO4中Na+含量(2分)
(4)2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O(2分)
(5)Mn2++2HCO3- MnCO3↓+CO2↑+H2O(2分)
MnCO3↓+CO2↑+H2O(2分)
NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;NH4HCO3受热分解损失(2分)
三氯异氰尿酸“有效氯”含量= ×100%=90%(1分)
×100%=90%(1分)
【解析】
试题分析:(1)该反应的反应物为二氧化硫和二氧化锰产物为硫酸锰;(2)反应经过三次除杂,一次是氧化除去亚铁离子,第三次是除去重金属得到纯净溶液,故第二次应除去铁铝杂质生成氢氧化物;(3)使用Na2S会引入杂质钠离子;(4)电解硫酸锰和硫酸铵溶液,阴极产生锰,阳极氢氧根离子放电产生氧气,4OH--4e-=O2↑+2H2O;(5)该反应的反应物为碳酸氢铵和硫酸锰,产物是碳酸锰,Mn2++2HCO3-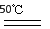 MnCO3↓+CO2↑+H2O;电解时溶液中产生氢离子溶液为酸性,会溶解碳酸盐,故加入过量碳酸氢铵反应调节溶液酸碱性,防止MnCO3沉淀溶解损失;碳酸氢铵不稳定受热易分解,故需多加试剂弥补分解损失。
MnCO3↓+CO2↑+H2O;电解时溶液中产生氢离子溶液为酸性,会溶解碳酸盐,故加入过量碳酸氢铵反应调节溶液酸碱性,防止MnCO3沉淀溶解损失;碳酸氢铵不稳定受热易分解,故需多加试剂弥补分解损失。
考点:考查化工流程中操作目的、原理有关问题。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省淄博市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
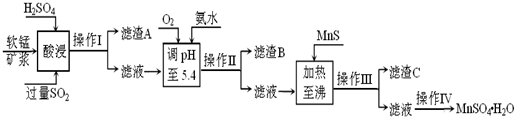
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
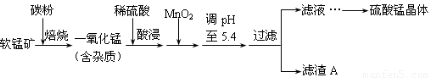
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
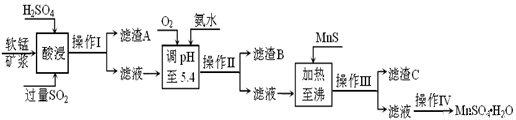
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
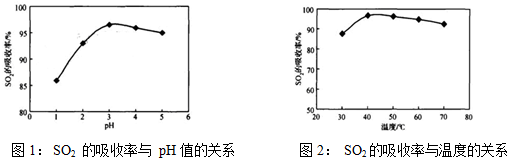
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com