
| A. | 所有△H<0的反应均是自发反应 | |
| B. | 高锰酸钾加热分解是一个熵减小的过程 | |
| C. | 冰在室温下自动熔化成水,是熵增的过程 | |
| D. | 自发进行的反应一定能迅速进行 |
分析 反应能自发进行,应满足△G=△H-T•△S<0,相同物质的量的同种物质熵值:气体>液体>固体,以此解答该题.
解答 解:A.△G<0反应自发进行,由△G=△H-T△S可知,△H<0时,若△S<0,则△G可能大于0,反应非自发,故A错误;
B.高锰酸钾分解生成气体,混乱度增加,熵值增大,故B错误;
C.反应向熵值方向进行,同种物质熵值:液体>固体,冰在室温下自动熔化成水,是熵增的重要结果,故C正确;
D..△G<0反应自发进行,能否发生还有反应速率问题,能自发进行,反应速率不一定大,如金属的腐蚀,故D错误.
故选C.
点评 本题考查化学反应进行方向的判断,为高频考点,侧重于学生的分析能力的考查,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过滤 萃取 分液 | B. | 萃取 分液 蒸馏 | C. | 分液 蒸馏 萃取 | D. | 萃取 蒸馏 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂 厨房清洁剂 醋 肥皂 | |
| B. | 醋 厕所清洁剂 厨房清洁剂 肥皂 | |
| C. | 厕所清洁剂 醋 肥皂 厨房清洁剂 | |
| D. | 厨房清洁剂 厕所清洁剂 肥皂 醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
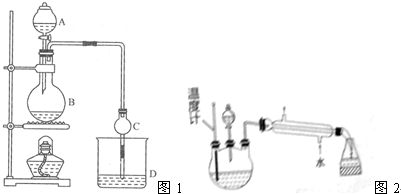
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com