
��10�֣���һ���¶��£���2 mol A��1 mol B�����������������Ϊ2 L��ij�ܱ�������(�ݻ�����)���������·�Ӧ��3A(g)��B(g) 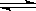 xC(g)��2D(g)��H<0��2 minĩ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��������1mol D�������C��Ũ��Ϊ0.5 mol��L��1������д���пհף�
xC(g)��2D(g)��H<0��2 minĩ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��������1mol D�������C��Ũ��Ϊ0.5 mol��L��1������д���пհף�
��1��x��ֵ����________________��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________�������¶�ʱKֵ��________(ѡ���������С�����䡱)��
��3��A���ʵ�ת����Ϊ__________________��
��4����ά���¶Ȳ��䣬��ԭƽ��������������ٳ���2mol C��2mol D����ʹ�ﵽ�µ�ƽ��ʱ�������ʵ����ʵ���������ԭƽ����ͬ��������Ӧ�ٳ���A�����ʵ���Ϊ________ mol��
19. (10��) ��1��2 ��2��16 ��С ��3��75% ��4�� 1
��������
�����������1��ƽ��ʱC��Ũ��Ϊ0.5mol/L����n��C��=0.5mol/L��2L=1mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����1mol��1mol=x��2�����x=2��
��2��3A(g)+ B(g) 2C(g)+2D(g)
2C(g)+2D(g)
��ʼ��mol���� 1 0.5 0 0
�仯��mol���� 0.75 0.25 0.5 0.5
ƽ�⣨mol����0.25 0.25 0.5 0.5
K=��0.52X0.52��/(0.253x0.25)=16���÷�ӦΪ���ȷ�Ӧ�����������¶ȣ�Kֵ��С��
��3��A���ʵ�ת����Ϊ(0.75/1) ��100%=75%��
��4�����ݵ�Чƽ�����ۣ�������������ά���¶Ȳ��䣬��ԭƽ��������������ٳ���2mol C��2mol D��1molA, �ﵽ�µ�ƽ��ʱ�������ʵ����ʵ���������ԭƽ����ͬ��
���㣺���黯ѧƽ�⡢��ѧ��Ӧ���ʵļ��㣬��Чƽ���֪ʶ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������������и߶���һ���¿��Ծ���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H+(aq) + OH��(aq) �T H2O(aq) ��H= ��57.3kJ/mol,����˵����ȷ����( )
A��NaOHϡ��Һ�ֱ���ϡ�����ϡ���ᷴӦ����1 mol H2O ,�ų�������ͬ
B��ϡ����ֱ���NaOHϡ��Һ��ϡ��ˮ��Ӧ����1 mol H2O ,�ų�������ͬ
C��Ba(OH)2ϡ��Һ�ֱ���ϡ�����ϡ���ᷴӦ����1 mol H2O ,�ų�������ͬ
D���÷�Ӧ˵����ˮ���ɵķ�Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��8�֣���һ�������������Na2CO3��Na2SO4��CuSO4��NaCl�Ȼ����ɣ�Ϊ�˼����������������ʣ���������ʵ�飺 �ٽ���������ˮ�������õ���ɫ����Һ��
��������Һ�еμ����ᱵ��Һ���а�ɫ�������ɣ�
�۹��ˣ�����������ϡ�����У����ֳ���ȫ���ܽ⡣
��1�����жϣ����������п϶����� ���϶�û�� ��
��2���Կ����е����ʣ��ɲ�������Һ�еμ� �����Լ����ƣ������飻
��3��д�������漰�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ��������������ԭ��Ӧ����
A��Fe+CuSO4===FeSO4+Cu
B��2HClO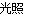 2HCl+ O2��
2HCl+ O2��
C��2Na2O2+ 2CO2===2Na2CO3+ O2��
D��CaCO3��H2O��CO2=== Ca(HCO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ���ǻ��Ϸ�Ӧ������������ԭ��Ӧ����
A��NaOH + HCl == NaCl + H2O
B��2CO + O2��ȼ2CO2
C��H2 + CuO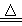 Cu + H2O
Cu + H2O
D��CaO + H2O == Ca(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�¶�Ϊ25 ��ʱ����0.23 g��Ͷ�뵽100 gˮ�г�ַ�Ӧ�����跴Ӧ����Һ���Ϊ100 mL�������Һ��pHΪ
A��1 B��10 C��12 D��13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¡����ݵ��ܱ������з�����ӦA(s)��2B(g) 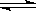 C(g)��D(g)�����������������ٱ仯ʱ���ܹ������÷�Ӧ�Ѵ�ƽ��״̬����
C(g)��D(g)�����������������ٱ仯ʱ���ܹ������÷�Ӧ�Ѵ�ƽ��״̬����
A����������ѹǿ
B����������ƽ����Է�������
C��A�����ʵ���Ũ��
D������������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�к���1.2��10��3 mol XO3����ǡ��������30mL 0.1mol/L����������Һ����
ԭ������Ԫ��X�Ļ��ϼ���?
A��0? B��-2 C��+1 D��+2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�����и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ŀǰ��һ����Ч������Ⱦ����������������(ClO2)�ѱ�������ҹ㷺Ӧ��������ˮ�Ĵ����ϡ���֪��ҵ���Ʊ��������ȵķ���֮һ���ü״������Խ������������Ʒ�Ӧ���䷴Ӧ��ϵΪCH3OH��6NaClO3��3H2SO4=6ClO2��CO2��3Na2SO4��5H2O��������˵����ȷ����
A���������Ǽ״�
B���������뻹ԭ�������ʵ���֮��Ϊ2��1
C�����������Ƕ�������
D����ԭ������������������ʵ���֮��Ϊ6��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com