
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
分析 A.过氧化钠具有强氧化性,可与二氧化碳反应生成氧气;
B.钠和钾的合金熔点较低,常温下是液体;
C.碳酸氢钠可与酸反应生成二氧化碳气体;
D.碳酸钠水解呈碱性,加热促进水解.
解答 解:A.过氧化钠具有强氧化性,可用作漂白剂,可与二氧化碳反应生成氧气,可用作供氧剂,故A正确;
B.钠和钾的合金熔点较低,常温下是液体,故B错误;
C.碳酸氢钠不稳定,加热易分解,且可与酸反应生成二氧化碳气体,可焙制糕点所用的发酵粉,也可用于治疗胃酸过多,故C正确;
D.碳酸钠水解呈碱性,加热促进水解,溶液碱性增强,有利于油脂的水解,故D正确.
故选B.
点评 本题综合考查钠的重要化合物,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖和稀硫酸共热 | |
| B. | 蛋白质溶液中加入饱和NaCl溶液,有沉淀析出 | |
| C. | 蛋白质溶液中加入浓NaOH溶液 | |
| D. | 氨基酸中加入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
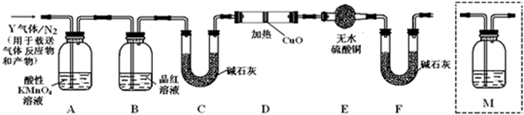
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

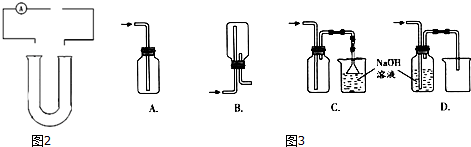
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
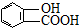 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥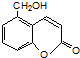

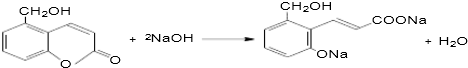
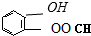 、
、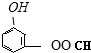 、
、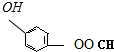
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2 OH.
OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
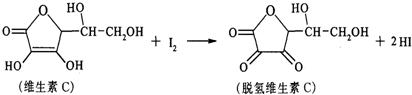
| A. | 上述反应为取代反应 | |
| B. | 维生素C能使高锰酸钾酸性溶液褪色 | |
| C. | 维生素C不溶于水,可溶于有机溶剂 | |
| D. | 维生素C的分子式为C6H10O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com