
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:江苏省扬州中学2011-2012学年高二下学期期中考试化学试卷 题型:022
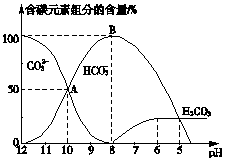
常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
(1)20 mL 0.1 mol·L-1 Na2CO3溶液呈碱性的原因是(用离子方程式表示)________.
(2)当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为________.
(3)B点表示的含义是________.
(4)当混合液的pH=________时,开始放出CO2气体.
查看答案和解析>>
科目:高中化学 来源: 题型:

(2)已知
B.Ksp(CaF2)随钙离子和氟离子浓度的增大而增大
C.该体系最终没有沉淀生成
D.该体系最终有沉淀生成
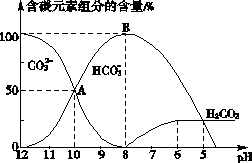
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(除CO2因逸出而未画)物质的量分数(纵轴)随溶液pH(横轴)变化的情况如下图。

请根据上图所示回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() (填“能”或“不能”) _________________大量共存。
(填“能”或“不能”) _________________大量共存。
②当pH=7时,用一个数学表达式表示溶液中各种离子的物质的量浓度之间的等量关系:_________________。
③已知在![]() (aq)水解反应的平衡常数:
(aq)水解反应的平衡常数:
Kh=![]() =2×10-4 mol·L-1
=2×10-4 mol·L-1
当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=_________________。
)=2∶1时,溶液的pH=_________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省西华一高高三上学期第一次月考化学试卷(带解析) 题型:填空题
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0  的
的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013届河南省西华一高高三上学期第一次月考化学试卷(解析版) 题型:填空题
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0  的
的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的
 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为
。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为
。

(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com