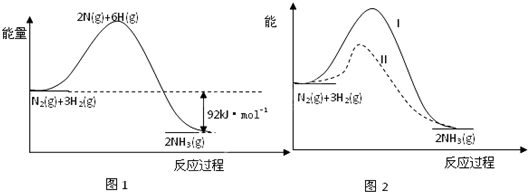
分析:(1)N
2和NO的质量比为14:15,令N
2和NO的总质量分别为28g、30g,根据n=
计算各自物质的量,计算N原子、O原子物质的量,进而计算N、O原子数目之比,再根据
=
计算平均摩尔质量;
(2)令质量为1g,根据n=
各气体物质的量,气体体积之比等于物质的量之比;计算各物质含有原子物质的量,比较原子大小;相同条件下,气体密度之比等于相对分子质量;
(3)根据n=计算
mL Al
2(SO
4)
3溶液中铝离子的质量,再根据n=
计算
mL Al
2(SO
4)
3溶液Al
3+的物质的量,由化学式中离子的关系可确定
mL Al
2(SO
4)
3溶液SO
42-的物质的量,然后利用c=
来计算稀释到V mL 溶液中SO
42-的物质的量浓度.
解答:
解:(1)N
2和NO的质量比为14:15,令N
2和NO的总质量分别为28g、30g,则N
2为1mol、NO为1mol,合气体中N
2和NO的物质的量之比为1:1,混合气体中氮原子和氧原子的个数比为(2mol+1mol):1mol=3:1,该混合气体的平均摩尔质量为
=29g/mol,
故答案为:1:1;3:1;29g/mol;
(2)令质量为1g,则:
①CO
2物质的量=
=
mol,含有原子为
mol×3=0.068mol,相对分子质量为44;
②H
2物质的量=
=0.5mol,含有原子为0.5mol×2=1mol,相对分子质量为2;
③O
2物质的量=
mol,含有原子为
mol×2=
mol=0.0625mol,相对分子质量为32;
④CH
4物质的量=
mol,含有原子为
mol×4=0.25mol,相对分子质量为16;
⑤SO
2物质的量=
mol,含有原子为
mol×3=0.0469mol,相对分子质量为64;
气体体积之比等于物质的量之比,故体积:②>④>③>①>⑤;
含有原子大小顺序为:②>④>①>③>⑤;
相同条件下,气体密度之比等于相对分子质量,故密度:⑤>①>③>④>②,
故答案为:②>④>③>①>⑤;②>④>①>③>⑤;⑤>①>③>④>②;
(3)V mL Al
2(SO
4)
3溶液中含有Al
3+a g,则
mL Al
2(SO
4)
3溶液中铝离子的质量为
ag;
所以
V mLAl
2(SO
4)
3溶液Al
3+的物质的量为
=
mol,
所以
V mLAl
2(SO
4)
3溶液SO
42-的物质的量=
mol×
=
amol,
所以稀释到V mL,溶液中SO
42-的物质的量浓度为
=
mol/L,
故答案为:
mol/L.



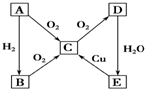 在通常状况下,A为固态单质.根据图转化关系,回答:
在通常状况下,A为固态单质.根据图转化关系,回答: