
| A. | 制造普通玻璃的原料是纯碱、石灰石和石英 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 二氧化硫有漂白性,可以使蓝色石蕊试纸褪色 | |
| D. | 漂白精、臭氧和活性炭都能用于游泳池的消毒 |
分析 A.玻璃的主要成分为硅酸钠、硅酸钙等;
B.酿酒的变化过程为淀粉到葡萄糖到乙醇;
C.二氧化硫不能漂白酸碱指示剂;
D.活性炭具有吸附作用.
解答 解:A.玻璃的主要成分为硅酸钠、硅酸钙等,可由纯碱、石灰石和石英为原料在高温下生成,故A正确;
B.以粮食为原料酿酒过程的变化包括粮食提取淀粉,淀粉水解生成葡萄糖,葡萄糖在酒化酶作用下反应生成乙醇,酿酒的变化过程为淀粉到葡萄糖到乙醇,故B正确;
C.二氧化硫不能漂白酸碱指示剂,故C错误;
D.活性炭具有吸附作用,可除去悬浮物,然后用漂白精、臭氧等杀菌消毒,故D正确.
故选C.
点评 本题考查较为综合,涉及化学与生产、生活以及环境的考查,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
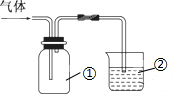
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
| B | NH3 | 酚酞溶液 | 溶液变红色 | NH3的水溶液显碱性 |
| C | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
| D | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
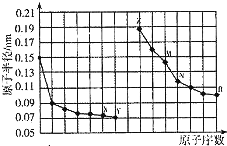
| A. | NX2一定不与酸反应 | |
| B. | R2与水反应时,水是还原剂 | |
| C. | 简单离子的半径:M<Z<X | |
| D. | 最高价氧化物对应水化物的碱性:Z<M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1Na2CO3溶液中含有0.1NACO32- | |
| B. | 4.2gN3-中含有的电子数为2.4NA | |
| C. | 6.4gCu与足量浓硝酸反应,一定转移0.2 NA个电子 | |
| D. | 常温常压下,22.4L H2O中共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 结论或推论 | |
| A | 溴水中加入甲苯,振荡 | 水层几乎呈无色 | 甲苯与溴发生了反应 |
| B | 一小粒金属钠投入无水乙醇中 | 最后钠浮在液面上 | 密度:乙醇大于钠 |
| C | Fe(SCN)3溶液中滴入足量NaOH溶液 | 澄清后得到无色溶液 | Fe(OH)3悬浊液中滴加KSCN溶液后不显红色 |
| D | 在含Mn2+的草酸溶液中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液褪色较快 | 反应过程中,Mn2+一定氧化了草酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中可能含钠元素 |
| B | 向某无色溶液中通人过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加少量MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
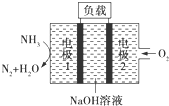
| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液pH值不变 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1molSO2和1molO2充分反应,转移的电子数为2×6.02×1023 | |
| B. | 在钢铁表面涂刷含铝粉的防锈漆,可以有效防止钢铁腐蚀 | |
| C. | 在室温下,向醋酸溶液中不断通入NH3,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$不断减小 | |
| D. | 室温下,反应Cl2(g)+H2O(l)═HCl(aq)+HClO(aq) 能自发进行,则△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com