
| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
分析 A、胶体不带电;
B、胶体和溶液的本质区别是分散质粒子直径大小;
C、根据氢氧化铁胶体的制备方法来分析;
D、丁达尔效应是胶体所特有的性质.
解答 解:A、胶体不带电,带电的是胶粒,故A错误;
B、胶体和溶液的本质区别是分散质粒子直径大小,即胶体的胶粒直径介于1-100nm之间,而溶液的分散质粒子小于1nm,故B错误;
C、讲饱和的氯化铁溶液滴入沸水中,继续煮沸,至溶液呈红褐色即停止加热,即可得氢氧化铁胶体,故C正确;
D、丁达尔效应是胶体所特有的性质,溶液没有,即硫酸铜溶液无丁达尔效应,故D错误.
故选C.
点评 本题借助氢氧化铁胶体,考查了氢氧化铁胶体的制备和胶体的性质,难度不大,注意基础的掌握.


科目:高中化学 来源: 题型:多选题
| A. | 常温下,向含有AgCl固体的饱和溶液,加少量水稀释,c(Ag+)和Ksp(AgCl)均保持不变 | |
| B. | pH=5的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 将水加热煮沸,能促进水的电离,Kw增大,pH增大,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
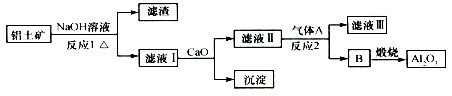
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
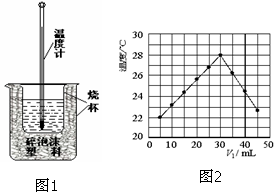 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com