
| A. | HF的电子式: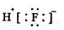 | |
| B. | S2-结构示意图: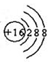 | |
| C. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| D. | 硝酸钙的电离方程式:Ca(NO3)2=Ca2++(NO3)22- |
分析 A.氟化氢是共价化合物,无阴阳离子;
B.原子结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层、第三层等,据此书写硫离子结构示意图;
C.异丁烷为丁烷同分异构体,在2号C含有1个甲基;
D.硝酸根离子书写错误.
解答 解:A.氟化氢的电子式为 ,故A错误;
,故A错误;
B.硫离子的质子数为16,有3个电子层,第一电子层容纳2个电子,第二电子层容纳8个电子,最外层容纳8个电子,离子结构示意图为: ,故B正确;
,故B正确;
C.CH3CH2CH2CH3为正丁烷的结构简式,异丁烷的结构简式为:CH3CH(CH3)2,故C错误;
D.硝酸钙电离时生成钙离子、硝酸根离子,其电离方程式为Ca(NO3)2═Ca2++2NO3-,故D错误;
故选B.
点评 本题考查了化学用语,根据电子式、结构示意图、结构简式、电离方程式的书写规则书写即可,题目难度不大,注意离子化合物和共价化合物电子式的书写区别.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:解答题
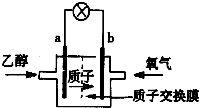 (1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O
(1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,则该溶液中一定含有钾离子 | |
| B. | 向某溶液中滴加足量稀盐酸,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 如果在蒸馏实验中忘记加沸石,可以先停止加热,待溶液冷却后补加沸石,再继续加热蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与CH3COOH溶液反应:Zn+2H+═Zn2++H2↑ | |
| B. | 氢氧化铝与稀硝酸反应:H++OH-═H2O | |
| C. | CuCl2溶液与铁粉反应:3Cu2++2Fe═3Cu+2Fe3+ | |
| D. | MgCl2溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C能促进人体对铁的吸收,利用了维生素C的氧化性 | |
| B. | 食品中大量添加苯甲酸钠灯防腐剂,可有效延长其保质期 | |
| C. | 《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是运用了焰色反应 | |
| D. | “从沙滩到用户”,计算机芯片的材料是指单质铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
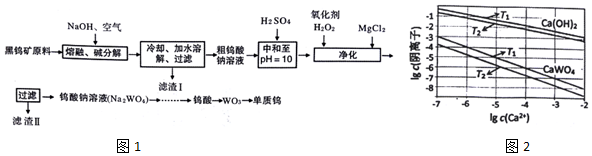
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
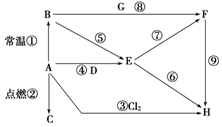 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com