

| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
分析 含钴废料中加入硫酸和亚硫酸钠,可得Co2+、Al3+、Fe2+、H+,加入NaClO3,可得到Fe3+,然后加入Na2CO3调pH至5.4,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)根据流程图结合信息浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等进行解答;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,铁离子水解生成氢氧化铁被除去,同时为溶液提供氯离子;
(3)由表中数据可知,调节溶液PH在5.4≤PH<7.6之间,可使Fe3+、Al3+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(4)根据从溶液中制取固体的方法制取氯化钴固体,从而确定操作步骤;
(5)根据铁离子和硫氰根离子络合呈血红色分析该滴定所用指示剂,先根据过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,求出与CoCl2•6H2O反应的AgNO3,再根据CoCl2•6H2O~2AgCl关系式求质量分数.
解答 解:(1)向水钴矿水钴矿(主要成分为Co2O3、Fe2O3、FeO、Al2O3等),加入硫酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3具有氧化性,能将Fe2+氧化成Fe3+,其发生反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,铁离子水解生成氢氧化铁,方便利用水解除去铁离子,同时为溶液提供氯离子,
故答案为:将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子;
(3)根据流程图可知,此时溶液中存在Fe3+、Al3+、Co2+金属离子,Fe3+、Al3+水解:Fe3++3H2O?Fe(OH)3+3H+、Al3++3H2O?Al(OH)3+3H+,步骤3中加入Na2CO3,CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,由金属阳离子以氢氧化物形式沉淀时的pH情况可知,调节溶液PH在5.4≤PH<7.6之间,可使Fe3+、Al3+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,生成Fe(OH)3、Al(OH)3沉淀而将其除去;5.4≤PH<7.6;
(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤,
故答案为:蒸发浓缩;冷却结晶;
(5)Fe3+遇SCN-溶液变为血红色,可作为检验Fe3+的特征试剂,为不引入杂质离子,所以该反应可用Fe(NO3)3作为滴定的指示剂,过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,消耗KSCN溶液20.00mL,则过量的硝酸银为n=cv=0.5mol/L×0.02L=0.01mol,先加入含AgNO30.03mol的溶液(杂质不反应),则与CoCl2•6H2O反应的硝酸银的物质的量为:0.03mol-0.01mol=0.02mol,设25.00mLCoCl2•6H2O溶液中含有CoCl2物质的量为x,
根据 CoCl2•6H2O~2AgCl~2AgNO3,
1 2
x 0.02mol x=0.01mol m(CoCl2•6H2O)=nM=0.01mol×238g/mol=2.38g,
则粗产品中CoCl2•6H2O的质量分数是 $\frac{2.38g×\frac{100mL}{25mL}}{11.9g}×100%$=80%,
故答案为:Fe(NO3)3;80%.
点评 本题通过制取CoCl2•6H2O的工艺流程,考查了物质制备方案的设计,题目难度中等,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 盐酸和醋酸,只要物质的量浓度相同,电离程度也相同 | |
| C. | 强电解质的稀溶液中不存在溶质分子 | |
| D. | 强电解质都是离子化合物,弱电解质都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时阳极获得O2 | |
| B. | 电解时阴极获得海绵钛 | |
| C. | 电解时阳极有Cl2放出 | |
| D. | 电解工艺一旦投入实际生产,钛将可与不锈钢和铝合金竞争 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式表明了分子中各原子的个数和连接方式 | |
| B. | 结构式、结构简式可表示分子中各原子的连接方式和相对位置 | |
| C. | 球棍模型可表示分子的真实形态 | |
| D. | 比例模型较真实反映分子空间构型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
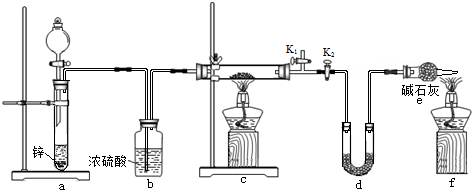
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
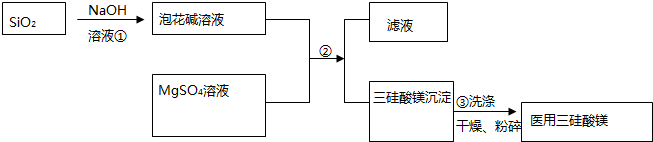
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
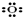 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+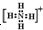 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com