
| A. | CuFeS2仅作还原剂,硫元素被氧化 | B. | SO2既是氧化产物又是还原产物 | ||
| C. | FeS既是氧化产物又是还原产物 | D. | 1molO2反应氧化2molCuFeS2 |
分析 反应2CuFeS2+O2═Cu2S+2FeS+SO2中,Cu元素化合价由+2价降低到+1价,O元素化合价由0价降低到-2价,为氧化剂,部分S元素化合价由-2价升高到+4价,以此解答该题.
解答 解:A.CuFeS2中Cu元素化合价降低,S元素化合价升高,则CuFeS2既是氧化剂也是还原剂,故A错误;
B.S元素化合价升高,O元素化合价降低,则SO2既是氧化产物又是还原产物,故B正确;
C.生成FeS,元素化合价没有发生不含,则FeS既不是氧化产物又不是还原产物,故C错误;
D.反应中Cu、O元素化合价降低,S元素化合价由-2价升高到+4价,1molO2反应氧化CuFeS2的物质的量少许2mol,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:实验题
| 实验编号 | a中试剂 | b中试剂 | 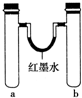 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气可供人呼吸但会使食物变质 | |
| B. | 化肥能促进植物生长但会污染土壤 | |
| C. | 一氧化碳可用于冶炼金属但会使人中毒 | |
| D. | 二氧化碳能灭火但会造成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积0.1mol/L HCl和0.01mol/L HCl反应 | |
| B. | 等质量锌粒和镁粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等量1 mol/L碳酸钠溶液 | |
| D. | 等体积0.2 mol/HCl 和0.1 mol/L H2SO4 与等量等表面积的石灰反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
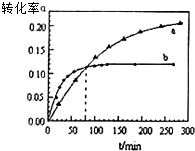 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com